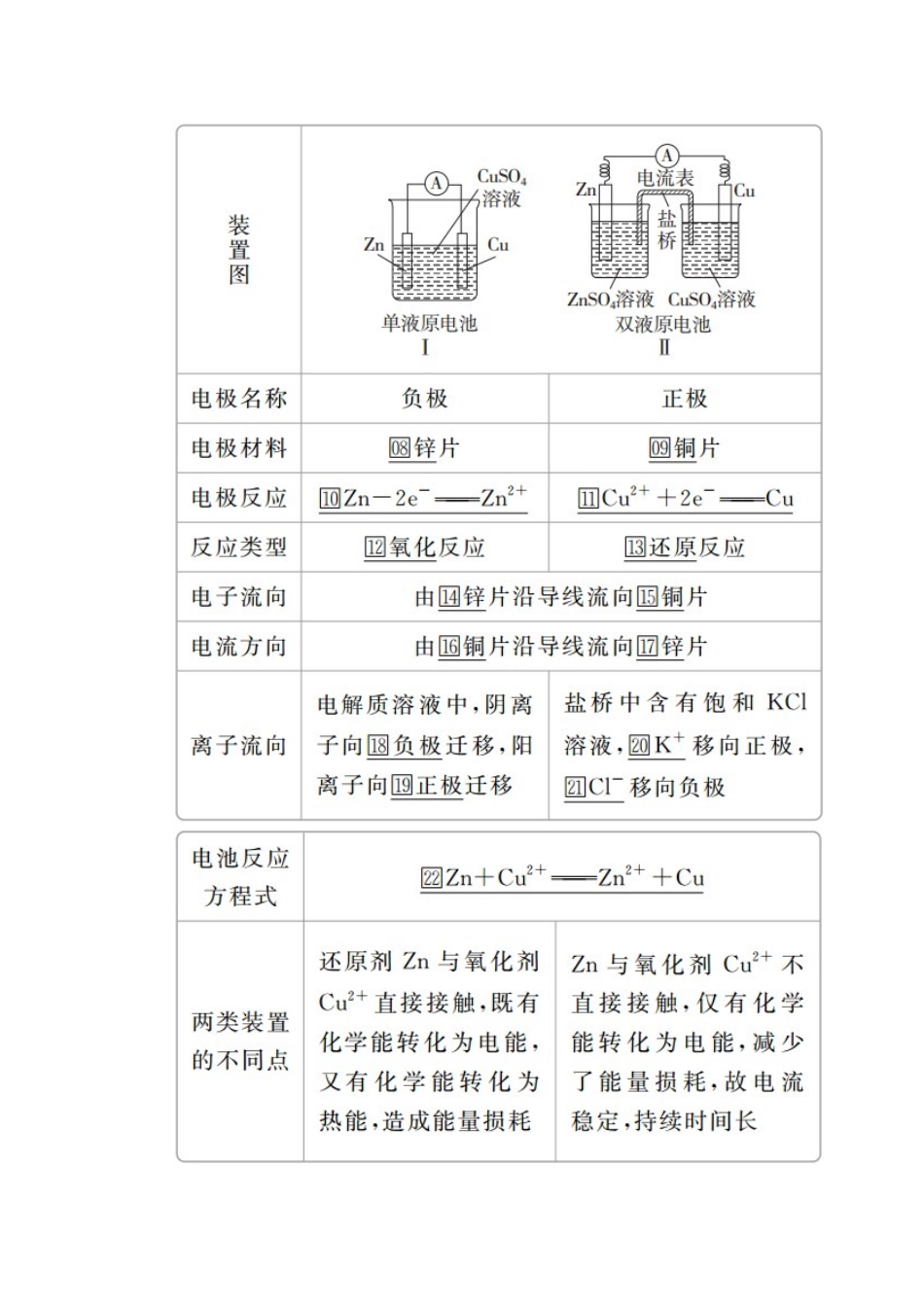
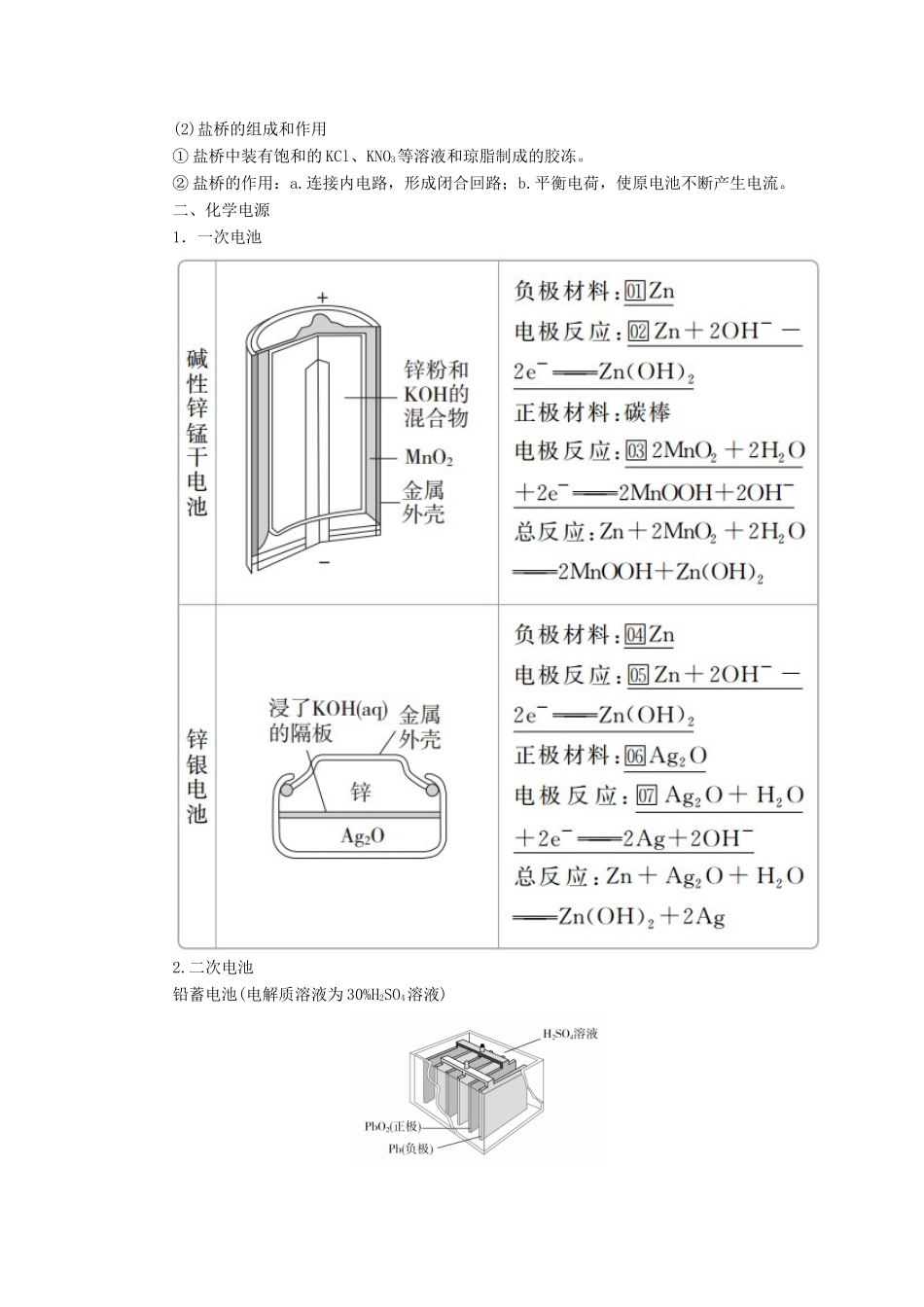
第九章电化学基础[考纲解读]1.理解原电池的构成、工作原理及应用。2.能书写出电极反应和总反应方程式。3.了解常见化学电源的种类及其工作原理。4.理解电解池的构成、工作原理及应用。5.了解金属发生电化学腐蚀的原因、金属腐蚀的危害以及防止金属腐蚀的措施。第28讲原电池化学电源一、原电池原理1.概念和反应本质原电池是把□化学能转化为□电能的装置,其反应本质是□氧化还原反应。2.构成条件(1)有能自发进行的□氧化还原反应。(2)□活泼性不同的两电极。(3)形成闭合回路。形成闭合回路需三个条件:①□电解质溶液;②两电极直接或间接接触;③两电极插入□电解质溶液中。3.工作原理(以铜-锌原电池为例)(1)反应原理(2)盐桥的组成和作用①盐桥中装有饱和的KCl、KNO3等溶液和琼脂制成的胶冻。②盐桥的作用:a.连接内电路,形成闭合回路;b.平衡电荷,使原电池不断产生电流。二、化学电源1.一次电池2.二次电池铅蓄电池(电解质溶液为30%H2SO4溶液)(1)放电时的反应负极反应:□Pb-2e-+SO===PbSO4,正极反应:□PbO2+2e-+SO+4H+===PbSO4+2H2O,总反应:Pb+PbO2+2H2SO4===2PbSO4+2H2O。电解质溶液的pH□增大(填“增大”“减小”或“不变”)。(2)充电时的反应阴极反应:□PbSO4+2e-===Pb+SO,阳极反应:□PbSO4+2H2O-2e-===PbO2+4H++SO,总反应:2PbSO4+2H2O=====Pb+PbO2+2H2SO4。3.燃料电池(1)氢氧燃料电池①氢氧燃料电池是目前最成熟的燃料电池。②燃料电池的电极本身不参与反应,燃料和氧化剂连续地由□外部供给。(2)甲烷燃料电池①碱性介质中(以KOH为例):负极:□CH4-8e-+10OH-===CO+7H2O,正极:□2O2+8e-+4H2O===8OH-,总反应:□CH4+2O2+2KOH===K2CO3+3H2O。②酸性介质中:负极:□CH4-8e-+2H2O===CO2+8H+,正极:□2O2+8e-+8H+===4H2O,总反应:□CH4+2O2===CO2+2H2O。1.判断正误,正确的画“√”,错误的画“×”,并指明错因。(1)理论上说,任何自发的氧化还原反应都可设计成原电池。(√)错因:_____________________________________________________________(2)在锌铜原电池中,因为有电子通过电解质溶液形成闭合回路,所以有电流产生。(×)错因:电子不能通过电解质溶液。(3)铅蓄电池放电时,正极与负极质量均增加。(√)错因:_____________________________________________________________(4)碱性锌锰干电池是一次电池,其中MnO2是催化剂,可使锌锰干电池的比能量高、可储存时间长。(×)错因:碱性锌锰干电池中的MnO2在正极上得电子,是氧化剂。(5)燃料电池工作时燃料在电池中燃烧,然后热能转化为电能。(×)错因:燃料电池直接将化学能转化为电能。(6)由于CaO+H2O===Ca(OH)2,可以放出大量的热,故可把该反应设计成原电池。(×)错因:该反应不是氧化还原反应,不能设计成原电池。(7)原电池工作时,溶液中的阳离子向负极移动,盐桥中的阳离子向正极移动。(×)错因:原电池工作时,溶液中的阳离子向正极移动。2.教材改编题(据人教必修二P44T1)原电池是利用______________反应、将________能转化为________能的装置。其中,负极是电子________的一极,发生________反应;正极是电子________的一极,发生________反应。答案能自发进行的氧化还原化学电流出氧化流入还原3.教材改编题(据人教选修四P78T3)镉镍可充电电池的充、放电反应按下式进行:Cd+2NiO(OH)+2H2OCd(OH)2+2Ni(OH)2,由此判断错误的是()A.放电时,Cd作负极B.放电时,NiO(OH)作负极C.电解质溶液为碱性溶液D.放电时,负极反应为Cd+2OH--2e-===Cd(OH)2答案B考点原电池的工作原理及应用[典例1](2018·江门质检)M、N、P、E四种金属,已知:①M+N2+===N+M2+;②M、P用导线连接放入硫酸氢钠溶液中,M表面有大量气泡逸出;③N、E用导线连接放入E的硫酸盐溶液中,电极反应为E2++2e-===E,N-2e-===N2+。则这四种金属的还原性由强到弱的顺序是()A.P>M>N>EB.E>N>M>PC.P>N>M>ED.E>P>M>N解析由①知,金属活动性:M>N;M、P用导线连接放入硫酸氢钠溶液中,M表面有大量气泡逸出,说明M作原电池的正极,故金属活动性:P>M;N、E构...