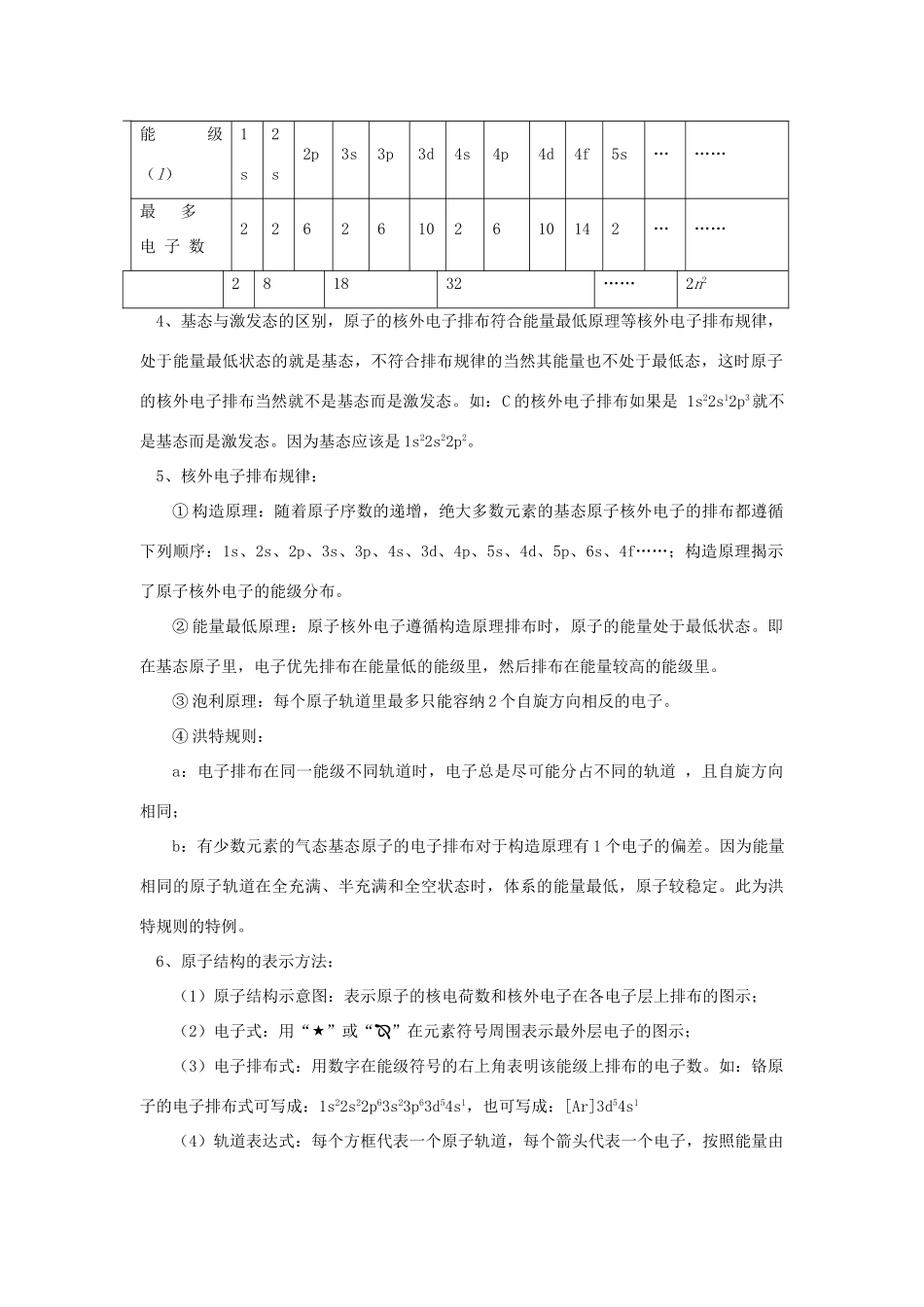
原子结构、元素周期律【本讲教育信息】一.教学内容:原子结构、元素周期律二.教学目标:了解元素、核素和同位素的含义。知道原子序数、核电荷数、质子数、中子数、核外电子数以及它们之间的相互关系;了解1~18号元素的原子核外电子排布,能用原子结构示意图表示原子和简单离子的结构;了解元素周期表(长式)的结构(周期、族)及其应用;认识元素周期律的本质。掌握同一周期、同一主族元素的原子结构与元素性质递变规律的关系;了解原子结构、元素在周期表中的位置及其性质递变的规律。三.教学重点、难点:1~18号元素的原子核外电子排布,能用原子结构示意图表示原子和简单离子的结构;元素周期律的本质。掌握同一周期、同一主族元素的原子结构与元素性质递变规律的关系;四.教学过程:(一)原子结构:原子的组成[说明]1、与原子结构有关的量之间的计算关系式:(1)质子数=核电荷数=核外电子数=原子序数(2)质量数(A)=质子数(Z)+中子数(N)2、人们把具有一定数目的质子和一定数目的中子的一种原子叫做核素。同一元素的不同核素之间互称同位素。同位素所研究的对象是微观粒子。同位素的特征:(1)同一元素的各种同位素质量数不同,但化学性质几乎完全相同。(2)在天然存在的某种元素里,不论是游离态还是化合态,各种同位素所占的原子个数百分比一般是不变的。3、能层与能级:按核外电子能量的的差异将其分成不同的能层(用符号n表示);各能层最多容纳的电子数为2n2,对于同一能层里能量不同的电子,还可将其分成不同的能级(l)。各能层所包含的能级类型及各能层、能级最多容纳的电子数见下表:能层(n)一二三四五六七符号KLMNOPQ能级(l)1s2s2p3s3p3d4s4p4d4f5s………最多电子数22626102610142………281832……2n24、基态与激发态的区别,原子的核外电子排布符合能量最低原理等核外电子排布规律,处于能量最低状态的就是基态,不符合排布规律的当然其能量也不处于最低态,这时原子的核外电子排布当然就不是基态而是激发态。如:C的核外电子排布如果是1s22s12p3就不是基态而是激发态。因为基态应该是1s22s22p2。5、核外电子排布规律:①构造原理:随着原子序数的递增,绝大多数元素的基态原子核外电子的排布都遵循下列顺序:1s、2s、2p、3s、3p、4s、3d、4p、5s、4d、5p、6s、4f……;构造原理揭示了原子核外电子的能级分布。②能量最低原理:原子核外电子遵循构造原理排布时,原子的能量处于最低状态。即在基态原子里,电子优先排布在能量低的能级里,然后排布在能量较高的能级里。③泡利原理:每个原子轨道里最多只能容纳2个自旋方向相反的电子。④洪特规则:a:电子排布在同一能级不同轨道时,电子总是尽可能分占不同的轨道,且自旋方向相同;b:有少数元素的气态基态原子的电子排布对于构造原理有1个电子的偏差。因为能量相同的原子轨道在全充满、半充满和全空状态时,体系的能量最低,原子较稳定。此为洪特规则的特例。6、原子结构的表示方法:(1)原子结构示意图:表示原子的核电荷数和核外电子在各电子层上排布的图示;(2)电子式:用“”或“”在元素符号周围表示最外层电子的图示;(3)电子排布式:用数字在能级符号的右上角表明该能级上排布的电子数。如:铬原子的电子排布式可写成:1s22s22p63s23p63d54s1,也可写成:[Ar]3d54s1(4)轨道表达式:每个方框代表一个原子轨道,每个箭头代表一个电子,按照能量由低到高的顺序由下而上所表示的电子排布图。如:7、光谱:不同元素的原子发生跃迁时会吸收(基态→激发态)和放出(激发态→基态)能量,产生不同的光谱—原子光谱(吸收光谱和发射光谱)。利用光谱分析可以发现新元素或利用特征谱线鉴定元素。(二)元素周期律与元素周期表:1、元素周期律:元素的性质随着元素原子序数的递增而呈周期性的变化,这个规律叫元素周期律。元素性质的周期性变化是元素原子的核外电子排布的周期性变化的必然结果,这就是元素周期律的实质。2、元素周期表是元素周期律的具体表现形式。在元素周期表中,把电子层数即能层相同的元素按原子序数递增的顺序从左到右排成一个横行,称为周期;再把最外层电子...