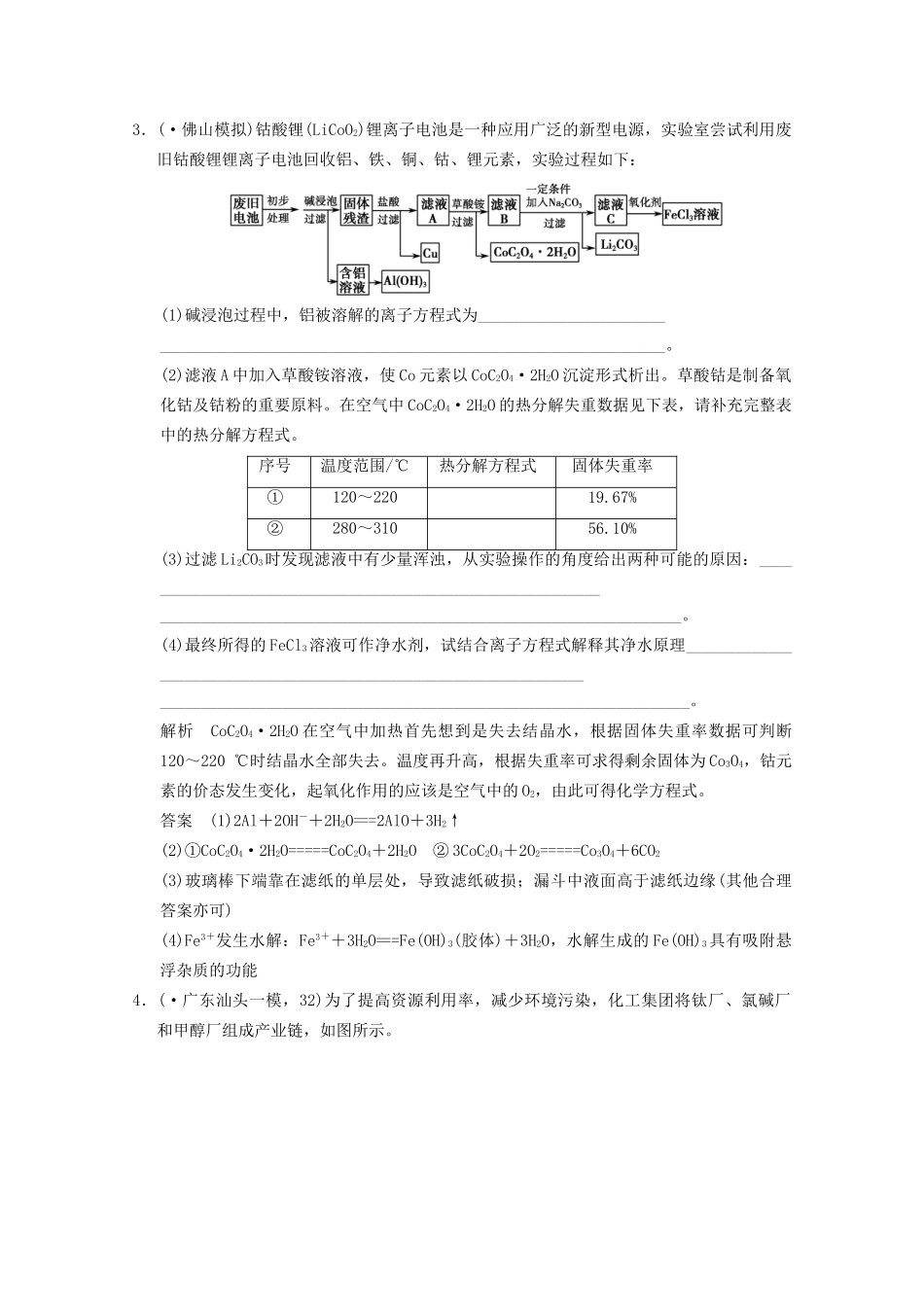
题型十八化学工艺流程题(建议完成时间:30分钟)1.(·汕头二模,26)铁及其化合物有重要用途,如聚合硫酸铁[Fe2(OH)n(SO4)3-n/2]m是一种新型高效的水处理混凝剂,而高铁酸钾(其中铁的化合价为+6)是一种重要的杀菌消毒剂,某课题小组设计如下方案制备上述两种产品:请回答下列问题:(1)若A为H2O(g),可以得到Fe3O4,写出H2O的电子式:________________。(2)若B为NaClO3与稀硫酸,写出其氧化Fe2+的离子方程式(还原产物为Cl-)________________。(3)若C为KNO3和KOH的混合物,写出其与Fe2O3加热共融制得高铁酸钾的化学方程式,并配平:(4)为测定溶液Ⅰ中铁元素的总含量,实验操作如下:准确量取20.00mL溶液Ⅰ于带塞锥形瓶中,加入足量H2O2,调节pH<3,加热除去过量H2O2;加入过量KI充分反应后,再用0.1000mol·L-1Na2S2O3标准溶液滴定至终点,消耗标准溶液20.00mL。已知:2Fe3++2I-===2Fe2++I2I2+2S2O===2I-+S4O。①写出滴定选用的指示剂________,滴定终点观察到的现象________________。②溶液Ⅰ中铁元素的总含量为________g·L-1。若滴定前溶液中H2O2没有除尽,所测定的铁元素的含量将会________(“”“”“”填偏高偏低或不变)。(5)设计实验方案,检验溶液Ⅰ中的Fe2+________________________________________________________________________________________________________________________________。解析(4)②若滴定前溶液中H2O2没有除尽,过量的H2O2氧化KI得到I2,根据关系式2Fe3+~I2,I2的量增大使所测定的铁元素的含量偏高。(5)可利用Fe2+的还原性,让其与高锰酸钾反应来检验;也可以利用铁氰化钾溶液与Fe2+反应生成具有特征蓝色的铁氰化亚铁沉淀检验,离子方程式为:3Fe2++2[Fe(CN)6]3-===Fe3[Fe(CN)6]2↓。答案(1)HOH(2)6Fe2++ClO+6H+===6Fe3++Cl-+3H2O(3)1342K2FeO432H2O(4)①淀粉溶液由蓝色变无色且保持半分钟不变色②5.6偏高(5)取溶液Ⅰ少量于试管中,加入硫酸酸化,再加入高锰酸钾溶液,溶液颜色从深紫色变成黄色或变浅,则含有Fe2+(或取溶液Ⅰ少量于试管中,加入铁氰化钾溶液,有蓝色沉淀生成,则含有Fe2+)2.氢溴酸在医药和石化工业上有广泛用途。下图是模拟工业制备氢溴酸粗产品并精制的流程:根据上述流程回答下列问题:(1)混合①中发生反应的离子方程式为_______________________________。(2)混合①中使用冰水的目的是_____________________________________。(3)操作Ⅲ一般适用于分离________混合物。(填序号)a.固体和液体b.固体和固体c.互不相溶的液体d.互溶的液体(4)混合②中加入Na2SO3的目的是__________________________________。(5)纯净的氢溴酸应为无色液体,但实际工业生产中制得的氢溴酸(工业氢溴酸)带有淡淡的黄色。于是甲乙两同学设计了简单实验加以探究:甲同学假设工业氢溴酸呈淡黄色是因为其中含有Fe3+,则用于证明该假设所用的试剂为________,若假设成立可观察到的现象为__________________;乙同学假设工业氢溴酸呈淡黄色是因为其中含有________________,其用于证明该假设所用的试剂为____________。解析SO2与Br2在水中发生氧化还原反应,反应放热,为防止溴蒸发,用冰水降温。操作Ⅰ、Ⅲ均是蒸馏,操作Ⅱ是过滤。混合②中加入Na2SO3的目的是除去粗产品中未反应完的溴。检验Fe3+常用KSCN溶液;工业氢溴酸中可能含有溴而呈淡黄色,可用四氯化碳萃取而证明。答案(1)SO2+Br2+2H2O===4H++2Br-+SO(2)降低体系温度,防止溴蒸发,使反应完全(3)d(4)除去粗产品中未反应完的溴(5)KSCN溶液溶液变成红色Br2CCl4(其他合理答案也可)3.(·佛山模拟)钴酸锂(LiCoO2)锂离子电池是一种应用广泛的新型电源,实验室尝试利用废旧钴酸锂锂离子电池回收铝、铁、铜、钴、锂元素,实验过程如下:(1)碱浸泡过程中,铝被溶解的离子方程式为_____________________________________________________________________________________。(2)滤液A中加入草酸铵溶液,使Co元素以CoC2O4·2H2O沉淀形式析出。草酸钴是制备氧化钴及钴粉的重要原料。在空气中CoC2O4·2H2O的热分解失重数据见下表,请补充完整表中的热分解方程式。序...