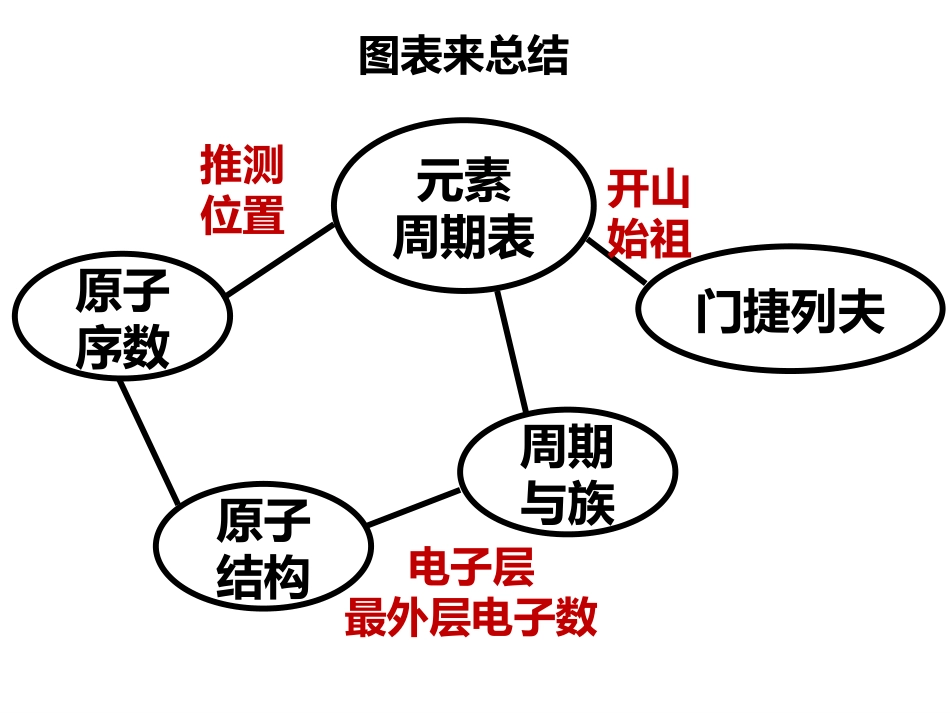
•第三课时南宁市育才实验中学李泽慧图表来总结元素周期表门捷列夫原子序数周期与族原子结构推测位置电子层最外层电子数开山始祖图表来总结原子结构的相似性元素性质的相似性原子结构的递变性元素性质的递变性决定决定碱金属原子最外层1e-,+1卤素原子最外层7e-,+7/-1碱金属元素金属性很强卤族元素非金属性很强决定核电荷数增大,电子层数增多原子半径增大Li→Cs,元素金属性增强F→I,元素非金属性减弱决定物理性质碱金属单质卤素单质银白色金属(铯略带金色光泽)密度、硬度均较小,熔沸点较低的固体热、电良导体密度逐渐增大K反常熔沸点逐渐降低硬度逐渐减小带有颜色密度逐渐增大熔沸点逐渐升高状态由气态变为液态再变为固态颜色逐渐加深研究整族元素性质的方法相似性递变性三、核素原子原子核核外电子质子Z中子N1、原子结构原子由这么多带电的粒子构成,但是,我们却没有触电的感觉?思考质子所带正电荷与电子所带负电荷,电量相等.结论一:核电荷数=核内质子数(Z)=核外电子数=原子序数结论二:原子的质量基本都集中在原子核.电子质子中子实际质量Kg9.109X10-311.673X10-271.675X10-271/18361.0071.008表二:构成原子的粒子及其性质相对质量质量数(A)=质子数(Z)+中子数(N)质量数定义:如果忽略电子的质量,将原子核内所有质子和中子的相对质量取近似值加起来,所得的数值.注意:当没给出相对原子质量时,质量数可近似代替相对原子质量使用2、原子表示方法XAZ——元素符号质量数——质子数——核内质子数(Z)=核电荷数=核外电子数质量数(A)=质子数(Z)+中子数(N)C126例:质量数—质子数—O168N2O2--2O2-ab+dXc+a——质量数,=质子数﹢中子数;b——核电荷数,=质子数≠电子数;c——离子所带电荷数;d——化合价abcd各代表什么?练习思考与C有什么区别?126C126C代表一个具体的碳原子C代表一个碳原子,或碳元素练习粒子符号质子数(Z)中子数(N)质量数(A)①O818②Al1427③Ar1822④Cl35⑤H1310401718101AZX4粒子符号质子数电子数①S2-②Xn+X③Ym-y④NH4+⑤OH-1618X-nY-m11109103、1g1H218O分子中,质子物质的量。0.5mol4、下列原子中共有种元素,种原子。①235U②14N③1H④3H⑤238U927119235思考是不是任何原子核都是由质子和中子构成的?不是,例如:11H试比较三种原子的异同点。质子数Z相同中子数不同,质量数不同属同种元素不同种原子101112123质子数中子数质量数H11H21H31AZX把具有一定数目的质子和一定数目的中子的原子叫核素。阅读课本p10,"核素"、"同位素"的概念分别是什么?把质子数相同而中子数不同的同一元素的不同原子互称为同位素。如:H11H12H13(D)(T)氕氘氚C6C6C6121314Cl1735Cl1737U92U92U922342352383、已知氢元素有3种同位素原子H、D、T。它们能形成多少种氢分子?有多少种不同的相对分子质量?H2D2T2HDHTDT相对分子质量:246345在天然存在的某种元素里,不论是游离态还是化合态,各种同位素所占的原子百分数(也叫丰度)是一定的。373537ClCl171735约75%约25%分别与构成的1molNaCl中,的物质的量是。Cl1735Cl1737Na1123Cl17370.25mol小结1、核素:2、同位素:具有一定数目的质子和一定数目的中子的一种原子。具有相同质子数而不同中子数的同种元素的不同原子互称为同位数。3、原子的相对原子质量原子的近似相对原子质量----质量数硼有两种天然同位素10B和11B,且知硼元素的近似相对原子量为10.8,请计算这两种同位素原子在自然界中的比例。55解:设10B的含量为x,则11B为1-x10.8=10x+11(1-x)解得x=0.2则两者的比值为1:4练习10电子粒子小结单核双核三核四核五核分子离子NeHFH2ONH3CH4N3-、O2-、F-Na+、Mg2+、Al3+OH-NH2-H3O+NH4+18电子粒子小结单核双核三核四核五核分子离子ArHClH2SPH3SiH4S2-、Cl-K+、Ca2+、HS-F2H2O2多核:N2H4、C2H6、CH3OH等