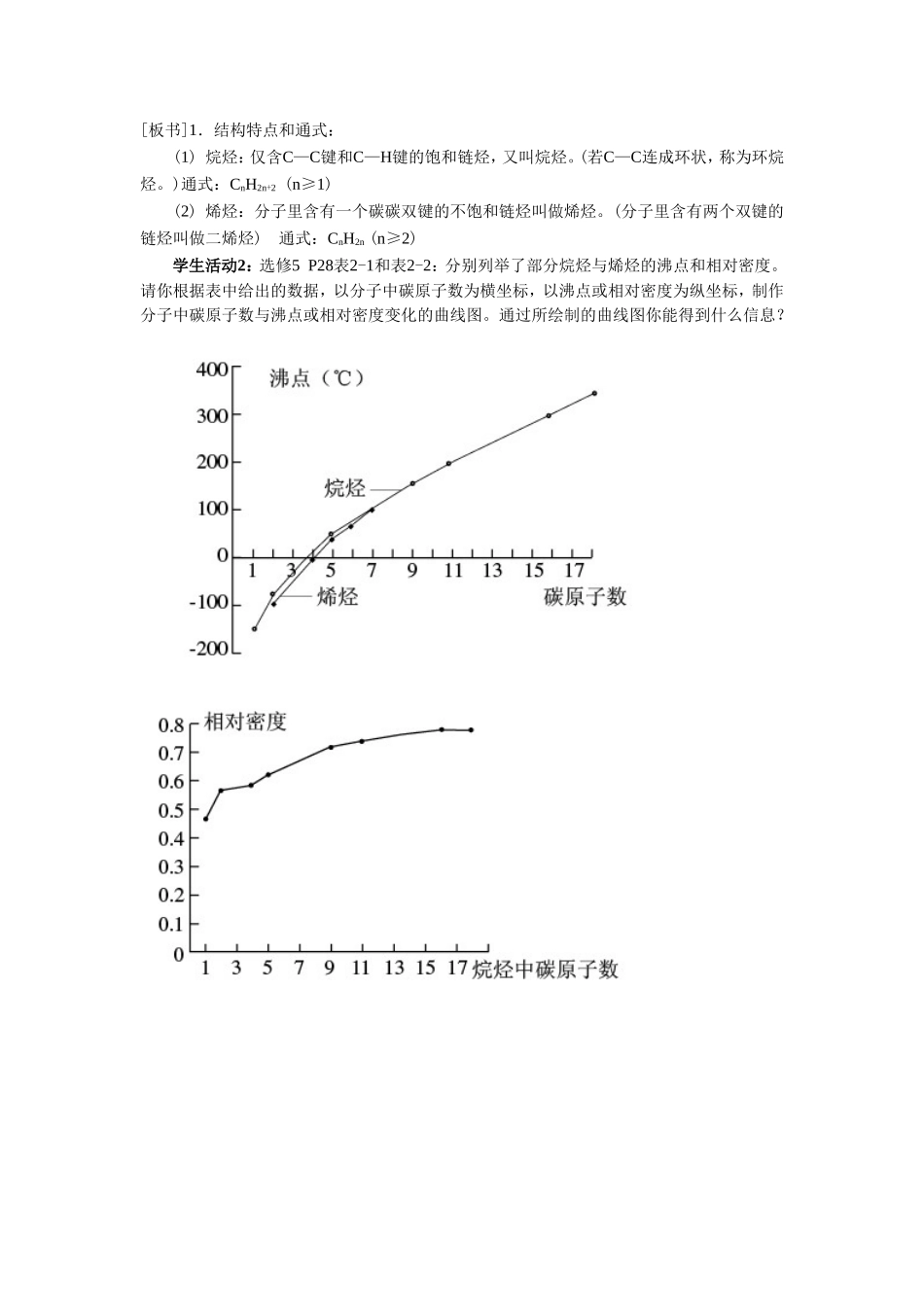
第一节脂肪烃【学习目标】1、知识与技能(1)了解脂肪烃沸点和相对密度的变化规律。以典型的脂肪烃为例,通过对比归纳的方式掌握烷烃、烯烃、炔烃的结构特点以及烷烃、烯烃的主要化学性质。(2)根据脂肪烃的组成和结构特点掌握加成、加聚和取代反应等重要的有机反应类型,并能灵活地加以运用。(3)理解烯烃的顺反异构,并能书写简单烯烃的顺反异构体。2、过程与方法(1)运用脂肪烃的分子模型,培养学生的观察能力和空间想象能力。(2)通过从甲烷、乙烯的结构和性质推出烷烃和烯烃的结构和性质,培养学生的知识迁移能力。3、情感态度与价值观(1)通过图片、模型等创设问题情景,激发学生学习的兴趣。(2)通过动手做烃的球棍模型,体验模型法在化学中的应用。【教材助读】1.掌握烷烃和烯烃的结构特点及通式2.烷烃和烯烃物理性质递变规律【预习反馈】1.复习甲烷、乙烯的结构和性质,讨论甲烷、乙烯的结构和性质的相似点和不同点,列表小结。2.烷烃通式:,烯烃通式:3.烷烃和烯烃密度递变规律:烷烃和烯烃熔沸点递变规律:【课堂探究】同学们,从这节课开始我们来学习第二章的内容——烃和卤代烃。在前面我们学习过甲烷、乙烯。根据结构的不同,烃可分为烷烃、烯烃、炔烃和芳香烃等。我们先来学习第一节——脂肪烃(揭示课题)[板书]一.烷烃和烯烃学生活动1:通过预习说说烷烃和烯烃的结构特点及通式。甲烷乙烯结构简式结构特点空间构型共性物理性质化学性质异性与溴的四氯化碳溶液与酸性高锰酸钾溶液主要反应类型[板书]1.结构特点和通式:(1)烷烃:仅含C—C键和C—H键的饱和链烃,又叫烷烃。(若C—C连成环状,称为环烷烃。)通式:CnH2n+2(n≥1)(2)烯烃:分子里含有一个碳碳双键的不饱和链烃叫做烯烃。(分子里含有两个双键的链烃叫做二烯烃)通式:CnH2n(n≥2)学生活动2:选修5P28表2-1和表2-2:分别列举了部分烷烃与烯烃的沸点和相对密度。请你根据表中给出的数据,以分子中碳原子数为横坐标,以沸点或相对密度为纵坐标,制作分子中碳原子数与沸点或相对密度变化的曲线图。通过所绘制的曲线图你能得到什么信息?[归纳总结]烷烃和烯烃溶沸点变化规律:[点拨引导]原子数相同时,支链越多,沸点越低。沸点的高低与分子间引力--范德华引力(包括静电引力、诱导力和色散力)有关。烃的碳原子数目越多,分子间的力就越大。支链增多时,使分子间的距离增大,分子间的力减弱,因而沸点降低。[板书]2.物理性质(1)物理性质随着分子中碳原子数的递增,呈规律性变化,沸点逐渐升高,相对密度逐渐增大;(2)碳原子数相同时,支链越多,熔沸点越低。(3)常温下的存在状态,也由气态(n≤4)逐渐过渡到液态(5≤n≤16)、固态(17≤n)。(4)烃的密度比水小,不溶于水,易溶于有机溶剂。学生活动3:阅读课本P.29[思考与交流],请写出其反应的化学方程式,指出反应类型并说说你的分类依据[投影](1)乙烷与氯气生成一氯乙烷的反应:;(2)乙烯与溴的反应:;(3)乙烯与水的反应:;(4)乙烯生成聚乙烯的反应:[归纳总结]有机基本反应类型[板书]3.基本反应类型[板书](1)取代反应:有机物分子里的某些原子或原子团被其他原子或原子团所取代的反应。如烃的卤代反应。[板书](2)加成反应:有机物分子中双键(叁键)两端的碳原子与其他原子或原子团所直接结合生成新的化合物的反应。如不饱和碳原子与H2、X2、H2O的加成。[板书](3)聚合反应:由相对分子质量小的化合物分子结合成相对分子质量较大的高分子化合物的反应。如加聚反应、缩聚反应。学生活动4:思考选修5课本P30[学与问],根据烷烃和烯烃结构的对比,尝试完成其中表格。[板书]4.烷烃和烯烃的化学性质[点拨引导]烷烃化学性质与甲烷相似,烷烃不能使酸性高锰酸钾溶液和溴水褪色。烯烃的化学性质与其代表物乙烯相似,容易发生加成反应、氧化反应和加聚反应。烯烃能使酸性KMnO4溶液和溴水褪色。[投影]烃的类别分子结构特点代表物主要化学性质烷烃烯烃[效果检测]完成下列反应的方程式:丙烯使溴水褪色的反应式为:丙烯与H2的反应:丙烯与HX的反应:丙烯发生加聚反应的方程式:[投影]1,2-二溴丙烷丙烷2-卤丙烷聚丙烯【当堂检测】1.由沸点数据:甲烷-146℃,乙烷-89℃,丁烷-...