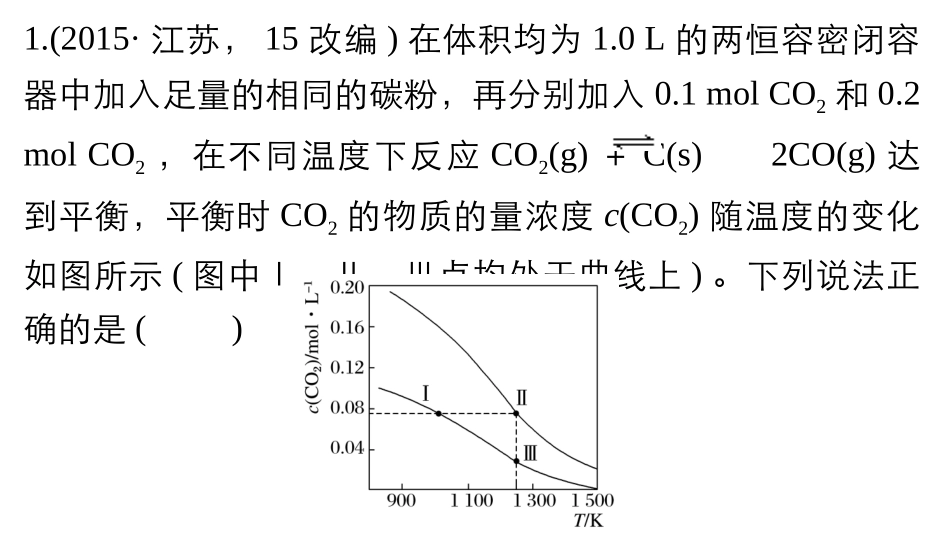
1.(2015·江苏,15改编)在体积均为1.0L的两恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1molCO2和0.2molCO2,在不同温度下反应CO2(g)+C(s)2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是()A.反应CO2(g)+C(s)===2CO(g)的ΔS>0、ΔH<0B.体系的总压强p总:p总(状态Ⅱ)>2p总(状态Ⅰ)C.体系中c(CO):c(CO,状态Ⅱ)>2c(CO,状态Ⅲ)D.逆反应速率v逆:v逆(状态Ⅰ)>v逆(状态Ⅲ)解析A项,C和CO2反应是吸热反应,ΔH>0,故A错误;B项,状态Ⅰ是通入0.1molCO2,状态Ⅱ是通入0.2molCO2,状态Ⅱ可以看作先通0.1molCO2,此时的压强相等,再通入0.1molCO2,假如平衡不移动,此时的压强等于2倍p总(状态Ⅰ),但要满足CO2的浓度相等,应对此体系加热使反应向正反应方向移动,气体物质的量增加,因此p总(状态Ⅱ)>2p总(状态Ⅰ),故正确;C项,状态Ⅱ可以看作先通0.1molCO2,此时两者CO的浓度相等,再通入0.1molCO2,假如平衡不移动,状态ⅡCO的浓度等于2倍状态Ⅲ,但再充入CO2,相当于增大压强,平衡右移,消耗CO,因此c(CO,状态Ⅱ)<2c(CO,状态Ⅲ),故错误;D项,温度越高,反应速率越快,v逆(状态Ⅰ)”、“<”或“=”),平衡常数K2________(填“增大”、“减小”或“不变”)。若要使K2减小,可采取的措施是_______________________。解析由题给数据可知,n(ClNO)=7.5×10-3mol·L-1·min-1×10min×2L=0.15mol。2NO(g)+Cl2(g)2ClNO(g)起始物质的量/mol0.20.1010min内转化的物质的量/mol0.150.0750.15平衡物质的量/mol0.050.0250.15故n(Cl2)=0.025mol;NO的转化率α1=×100%=75%。0.15mol0.2mol其他条件保持不变,由恒容条件(2L)改为恒压条件,因该反应是气体分子数减小的反应,平衡正向移动,NO的转化率增大,即α2>α1;平衡常数只是温度的函数,故由恒容条件改为恒压条件时平衡常数不变;要使平衡常数减小,平衡应逆向移动,因为反应(Ⅱ)是放热反应,故应升高温度。答案2.5×10-275%>不变升高温度3.(2015·四川理综,7)一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g)2CO(g),平衡时,体系中气体体积分数与温度的关系如下图所示:已知:气体分压(p分)=气体总压(p总)×体积分数。下列说法正确的是()A.550℃时,若充入惰性气体,v正、v逆均减小,平衡不移动B.650℃时,反应达平衡后CO2的转化率为25.0%C.T℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动D.925℃时,用平衡分压代替平衡浓度表示的化学平衡常数Kp=24.0p总解析A项,C(s)+CO2(g)2CO(g)的正反应是气体物质的量增加的反应,由于反应容器为体积可变的恒压密闭容器,充入惰性气体容器体积扩大,对反应体系相当于减小压强,故v正、v逆均减小,平衡正向移动,错误;B项,由图可知,650℃时若设起始时CO2的体积为1L,平衡时CO2消耗的体积为xL,则C(s)+CO2(s)2CO(g)V始10V变x2xV平1-x2x×100%=40.0%,x=0.25,CO2的转化率为25%,正确;2x1-x+2xC项,由图可知,T℃时平衡体系中CO和CO2的体积分数均为50%,故恒压时充入等体积的CO2和CO两种气体平衡不发生移动,错误;D项,925℃时,CO的平衡分压p(CO)=p总×96.0%,CO2的平衡分压...