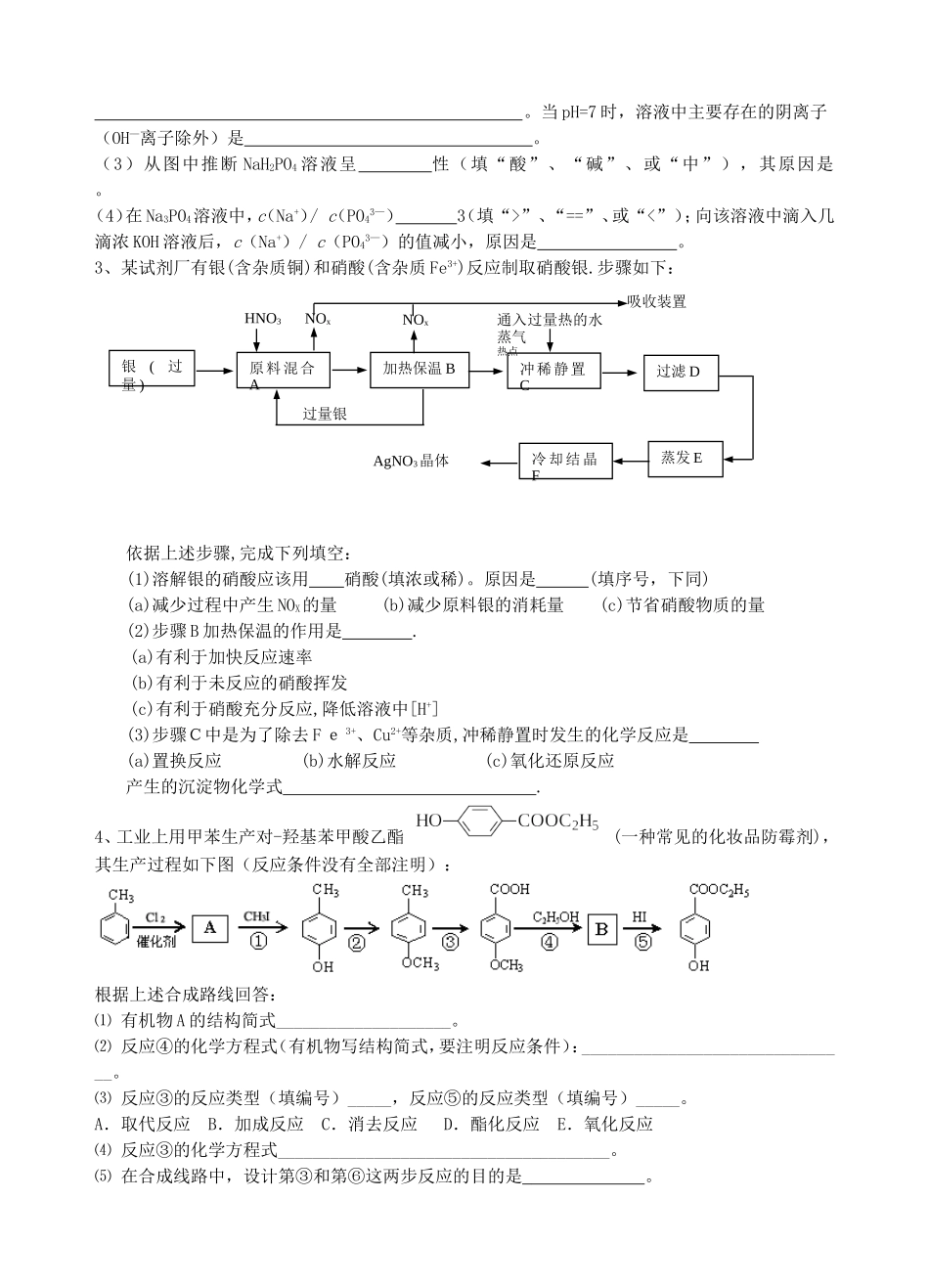
南师大第二附属高级中学高三化学二卷典型题训练二1、氢氧化铜是一种常用试剂。例如,利用新制氢氧化铜验证醛类物质的还原性。I.新制氢氧化铜悬浊液的配制实验室制取新制氢氧化铜悬浊液的操作方法:在试管里加入10%的氢氧化钠溶液2mL,滴入2%的硫酸铜溶液4滴~6滴,振荡即成。这样操作的目的是。下面是三个研究性学习组分别从不同层面开展研究性学习活动:II.研究性学习小组甲:对教材实验结论"乙醛与新制氢氧化铜反应生成的红色沉淀是Cu2O"提出质疑,他们认为红色沉淀不一定是氧化亚铜。为了确定红色沉淀的成分,开展了如下研究:提出猜想:。查阅资料:①氧化亚铜属于碱性氧化物;②+1价的铜离子在酸性条件下易发生自身氧化还原反应;③在空气中灼烧氧化亚铜生成氧化铜。设计方案:方案1:取该红色沉淀溶于足量的稀硝酸中,观察溶液颜色变化方案2:取该红色沉淀溶于足量的稀硫酸中,观察是否有残渣方案3:称取红色沉淀ag,在空气中充分灼烧至完全变黑,并在干燥器里冷却,再称重,反复多次至到固体恒重,称得质量为bg,比较a,b关系方案4:取红色固体沉淀装入试管里,加入酸化的硝酸银溶液,观察是否有银白色银析出。你认为合理的方案是。III.研究性学习小组乙针对小组甲的质疑,设计新的探究方案,装置如图所示。你认为要测定上述红色沉淀成分必须测定下列哪些物理量:。①通入氢气体积;②反应前,红色沉淀+硬质试管的总质量;③完全反应后红色固体+硬质试管的总质量;④实验前,干燥管质量;⑤硬质试管质量;⑥锌粒质量;⑦稀硫酸中含溶质的量;⑧实验后,干燥管质量IV.研究性学习小组丙上网查阅新闻得知,"2005年诺贝尔化学奖授予了三位研究绿色化学的科学家"。绿色化学强调对环境友好,实现零排放。"变废为宝"符合绿色化学要求。他们收集上述红色沉淀制备化学试剂--蓝矾。请你帮助他们设计一个简单且符合绿色化学要求的实验方案:。2、磷酸(H3PO4)在溶液中能够以H3PO4、H2PO4—、HPO42—、和PO43—四种粒子形式存在,当溶液的pH发生变化时,其中任一种粒子的物质的量占四种粒子总物质的量的分数δ也可能发生变化。下图是H3PO4溶液中,各种粒子的物质的量分数δ随pH的变化曲线:(1)设磷酸总浓度为c(总),写出c(总)与各粒子浓度间的关系式。(2)向Na3PO4溶液中逐滴滴入稀盐酸,当pH从9降到6的过程中发生的主要反应的离子方程式为。当pH=7时,溶液中主要存在的阴离子(OH—离子除外)是。(3)从图中推断NaH2PO4溶液呈性(填“酸”、“碱”、或“中”),其原因是。(4)在Na3PO4溶液中,c(Na+)/c(PO43—)3(填“>”、“==”、或“<”);向该溶液中滴入几滴浓KOH溶液后,c(Na+)/c(PO43—)的值减小,原因是。3、某试剂厂有银(含杂质铜)和硝酸(含杂质Fe3+)反应制取硝酸银.步骤如下:依据上述步骤,完成下列填空:(1)溶解银的硝酸应该用硝酸(填浓或稀)。原因是(填序号,下同)(a)减少过程中产生NOX的量(b)减少原料银的消耗量(c)节省硝酸物质的量(2)步骤B加热保温的作用是.(a)有利于加快反应速率(b)有利于未反应的硝酸挥发(c)有利于硝酸充分反应,降低溶液中[H+](3)步骤C中是为了除去Fe3+、Cu2+等杂质,冲稀静置时发生的化学反应是(a)置换反应(b)水解反应(c)氧化还原反应产生的沉淀物化学式.4、工业上用甲苯生产对-羟基苯甲酸乙酯(一种常见的化妆品防霉剂),其生产过程如下图(反应条件没有全部注明):根据上述合成路线回答:⑴有机物A的结构简式____________________。⑵反应④的化学方程式(有机物写结构简式,要注明反应条件):_______________________________。⑶反应③的反应类型(填编号)_____,反应⑤的反应类型(填编号)_____。A.取代反应B.加成反应C.消去反应D.酯化反应E.氧化反应⑷反应③的化学方程式______________________________________。⑸在合成线路中,设计第③和第⑥这两步反应的目的是。过量银原料混合A加热保温B冲稀静置C过滤DAgNO3晶体蒸发E冷却结晶F吸收装置银(过量)HNO3NOxNOx通入过量热的水蒸气热点5、已知在25℃的水溶液中,AgX、AgY、AgZ均难溶于水,且Ksp(AgX)==1.8×10-10,Ksp(AgY)==1.0×10-12,Ksp(AgZ)==8.7×10-17;...