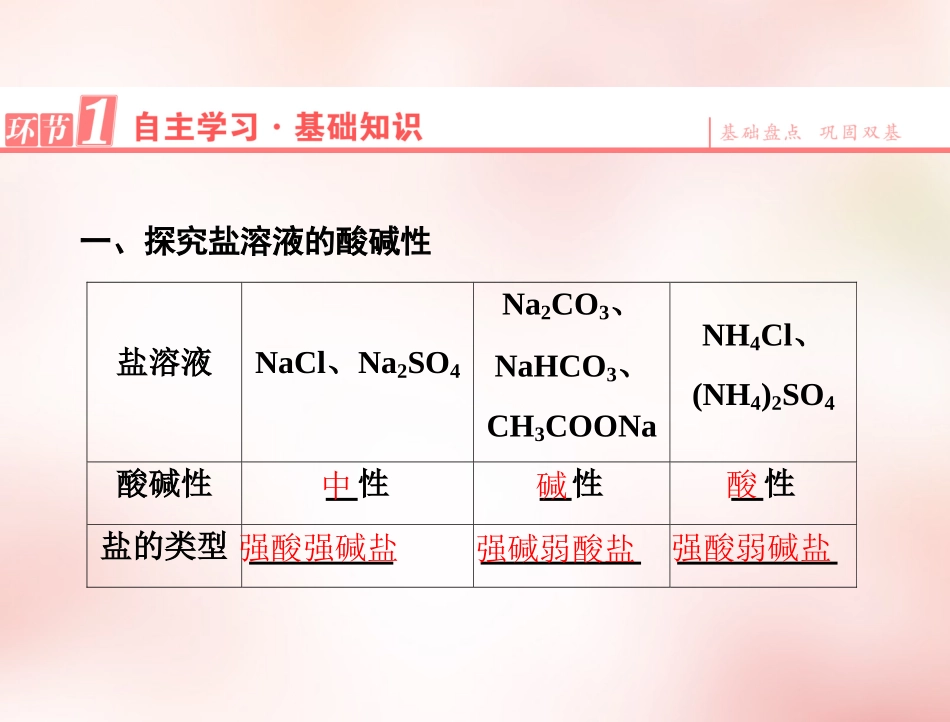
自主学习·基础知识自主学习·基础知识解疑合探·重难释疑解疑合探·重难释疑学科素养·实验探究学科素养·实验探究第三节盐类的水解第1课时盐类水解的原理[学习目标]1.通过实验归纳盐溶液的酸碱性与其类型之间的关系,探究盐溶液呈现不同酸碱性的原因,总结其规律。(重点)2.熟练掌握盐类水解的表示方法——水解离子方程式的书写。一、探究盐溶液的酸碱性盐溶液NaCl、Na2SO4Na2CO3、NaHCO3、CH3COONaNH4Cl、(NH4)2SO4酸碱性性性性盐的类型中碱酸强酸强碱盐强碱弱酸盐强酸弱碱盐1.FeCl3溶液,NaClO溶液,KNO3溶液分别呈什么性(酸性、碱性、中性)?【提示】FeCl3溶液—酸性,NaClO溶液—碱性,KNO3溶液—中性。2.NaHSO4溶液显酸性还是碱性?原因是什么?【提示】NaHSO4溶液呈酸性,原因是NaHSO4===Na++H++SO2-4。二、盐溶液呈现不同酸、碱性的原因1.理论分析(1)NH4Cl溶液理论解释NH+4和OH-结合生成弱电解质,使水的电离平衡向的方向移动。平衡时酸碱性使溶液中c(H+)c(OH-),溶液呈性总的离子方程式NH3·H2O电离>酸NH+4+H2ONH3·H2O+H+(2)CH3COONa溶液理论解释和结合生成弱电解质,使水的电离平衡向的方向移动平衡时酸碱性使溶液中c(H+)c(OH-),溶液呈性总的离子方程式CH3COO-H+CH3COOH电离<碱CH3COO-+H2OCH3COOH+OH-(3)NaCl溶液H2OOH-+H+,NaCl===Na++Cl-,溶液中盐电离的离子不能与H2O电离出的H+或OH-生成。c(H+)c(OH-),呈。弱电解质=中性2.定义和实质在溶液中盐电离出来的弱酸根阴离子或弱碱阳离子结合水电离出的,破坏了水的电离平衡,了水的电离,使溶液显示不同的酸性、碱性或中性。H+或OH-促进3.CuCl2溶液呈酸性,碱性还是中性?用离子方程式进行解释。【提示】酸性。Cu2++2H2OCu(OH)2+2H+。4.pH均为4的H2SO4溶液和NH4Cl溶液中,水电离出的c(H+)相等吗?【提示】不相等。H2SO4抑制水的电离,水电离出的c(H+)H2O=1×10-10mol/L,NH4Cl能水解,溶液中H+全部是水电离的为1×10-4mol·L-1,促进水的电离,所以NH4Cl溶液中水电离出的c(H+)大。1.易误诊断(1)在NaCl溶液中,c(Na+)=c(Cl-)。()(2)在NH4Cl溶液中,c(NH+4)=c(Cl-)()(3)所有的盐在水溶液中都发生水解反应()(4)盐类水解的实质是破坏了水的电离平衡,促进了水的电离。()【答案】(1)√(2)×(3)×(4)√2.下列说法正确的是()A.盐溶液都是中性的B.盐溶液的酸碱性与盐的类型无关C.碳酸钠溶液显碱性,是因为溶液中c(OH-)>c(H+)D.NaHCO3溶液显酸性【解析】盐溶液有的显酸性、有的显碱性,并不是所有的盐溶液都是中性,所以A错;盐溶液的酸碱性和盐的类型有密切关系,所以B错;溶液呈酸性或碱性,决定于溶液中c(OH-)和c(H+)的相对大小,碳酸钠溶液显碱性,则说明溶液中c(OH-)>c(H+),所以C对;NaHCO3虽是酸式盐,但其水溶液显碱性,所以D项叙述错误。【答案】C3.物质的量浓度相同的下列溶液中,符合按pH由小到大的顺序排列的是()A.Na2CO3、NaHCO3、NaCl、NH4ClB.Na2CO3、NaHCO3、NH4Cl、NaClC.(NH4)2SO4、NH4Cl、NaNO3、Na2SD.NH4Cl、(NH4)2SO4、Na2S、NaNO3【解析】本题主要利用盐类水解的原理判断盐溶液酸碱性的强弱。(NH4)2SO4、NH4Cl溶液因NH+4水解而呈酸性。(NH4)2SO4中的NH+4浓度大于NH4C1溶液的,故前者pH小;NaNO3溶液呈中性(pH=7);Na2S溶液因S2-水解而呈碱性(pH>7),选C。【答案】C4.有下列盐溶液:①KNO3②CuSO4③K2CO3④FeCl3⑤K2SO4⑥NaClO⑦NH4Cl呈酸性的是_____,呈碱性的是______,呈中性的是_____。【答案】②④⑦③⑥①⑤学生分组探究一盐类水解的规律和盐溶液的酸碱性第1步探究——问题引入,自主探究1.Na2CO3俗称纯碱,其水溶液也呈碱性,那么Na2CO3是碱吗?如果不是,请分析其水溶液呈碱性的原因。【提示】不是碱,Na2CO3属于盐。其水溶液呈碱性的原因:Na2CO3溶于水后能电离出CO2-3,它结合了水电离出的H+,从而促进了水的电离,使溶液中c(OH-)>c(H+)而显碱性。2.强酸强碱盐不水解,所以强酸强碱盐的水溶液都呈中性,对吗?【提示】不对,大多数强酸强碱盐的水溶液呈中性,但也有例外。如NaHSO4,它...