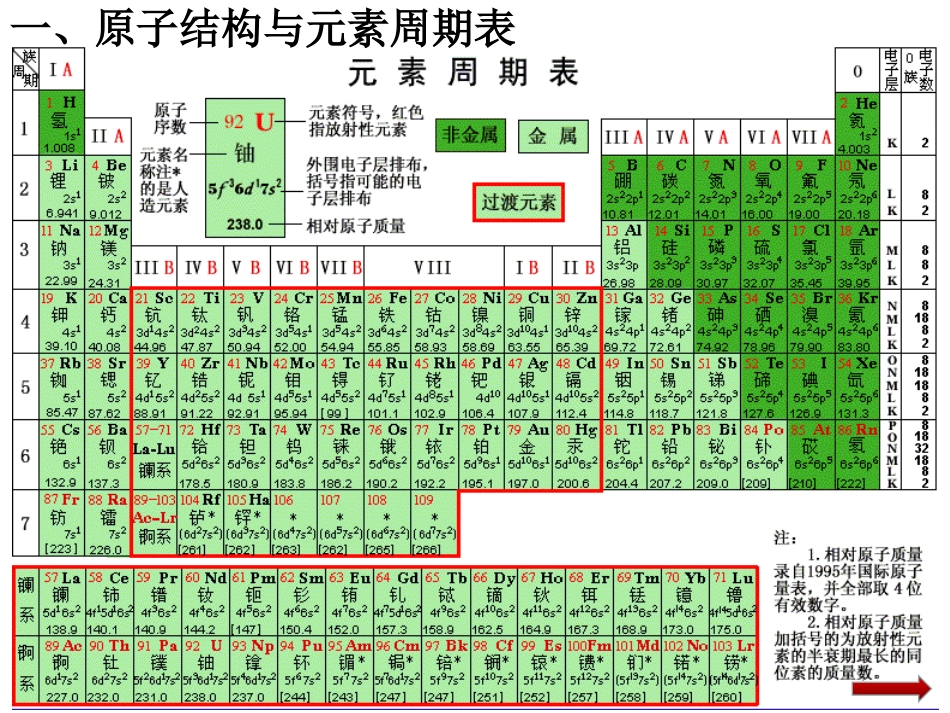
第二节原子结构与元素性质原子结构与元素周期表(第一课时)一、原子结构与元素周期表短周期长周期第1周期:2种元素第2周期:8种元素第3周期:8种元素第4周期:18种元素第5周期:18种元素第6周期:32种元素第7周期:32种元素镧57La–镥71Lu共15种元素称镧系元素锕89Ac–铹103Lr共15种元素称锕系元素周期序数=电子层数周期(横行)知识回顾:元素周期表的结构主族:副族:ⅠA,A,A,A,A,A,AⅡⅢⅣⅤⅥⅦ第VIII族:稀有气体元素主族序数=最外层电子数族(纵行)0族:共七个主族ⅠB,B,B,B,B,B,BⅡⅢⅣⅤⅥⅦ共七个副族三个纵行(8、9、10)知识回顾:元素周期表的结构元素的原子核外电子的排布发生周期性的重复1、元素期系的形成一、原子结构与元素周期表⑴形成⑵原因循环往复周期元素种数金属元素种数各周期增加的能级一201s二822s、2p三833s、3p四18144s、3d、4p五18155s、4d、5p六32306s、4f、5d、6p七32(?)?7s、5f、6d、7p2、周期表中周期所含元素种类的变化规律周期不是单调的(比喻成螺壳上的螺旋)原因随着核电核数的递增,电子在能级里的填充顺序遵循构造原理3、原子的电子排布与周期的划分一、原子结构与元素周期表4、原子的电子排布与族的划分①最外层电子的排布式通式ns1→ns2np6(第一周期例外)②最大能层数=周期序数(钯除外)(1)外围电子排布指能级上的电子数可在化学反应中发生变化的能层。(2)价电子价电子层上的电子主族元素:主族序数=最外层电子数=价电子数副族元素(大多数):价电子数=(n-1)d+ns的电子数每个纵列的价电子层的电子总数相等族数ⅠAⅡAⅢAⅣAⅤAⅥAⅦA价电子构型ns1ns2ns2np1ns2np2ns2np3ns2np4ns2np5(简称“价电子层”)(3)外围电子(价电子)排布式表示价电子排布的表示式ⅠA01ⅡAⅢAⅣAⅤAⅥAⅦA2p区3s区ⅢBⅣBⅤBⅥBⅦBⅧⅠBⅡB4d区ds区567镧系f区锕系元素周期表的五个分区0价电子总数=主族序数5、原子的价电子构型与元素的分区⑴s区有两个纵列:AⅠ、ⅡA价电子构型:ns1~2⑵p区有六个纵列:AⅢ~ⅦA、0族价电子构型:ns2np1~6价电子总数=主族序数(0族除外)⑶d区有八个纵列:BⅢ~ⅦB、VIII族价电子构型:(n-1)d1~9ns1~2价电子总数=纵列数=副族序数5、原子的价电子构型与元素的分区⑷ds区有两个纵列:BⅠ、ⅡB价电子构型:(n-1)d10ns1~2价电子总数=纵列数⑸f区包括镧系与锕系价电子构型:(n-2)f0~14(n-1)d0~2ns26、原子结构与元素在周期表中的位置的关系(1)原子的电子层数决定元素所在的周期周期序数=最大能层数(钯除外)(2)原子的价电子总数决定所在的族主族元素:价电子总数=主族序数过渡元素:价电子总数=纵列数已知某元素在周期表中位于第五周期、ⅥA族位置上。试写出该元素基态原子的价电子排布式、电子排布式并分析该元素在哪区?由于是ⅥA族,4d必是全充满的,所以价电子排布为5s25p4,电子排布式[Kr]4d105s25p4课堂练习属P区2、已知某元素的价电子层结构为3d54s2,试确定其在周期表中的位置。第四周期,ⅦB族。课堂练习3.试确定32号元素在周期表中的位置。第四周期,ⅣA族1、原子半径⑴影响因素电子的能层数核电荷数二、元素周期律同周期主族元素,从左到右,原子半径逐渐减小同主族元素,从上到下,原子半径逐渐增大⑵变化规律元素的性质随核电荷数递增发生周期性的递变2、电离能⑴定义气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量,叫做第一电离能。用符号I1表示,单位:kJ/mol元素的第一电离能越小,原子越容易失去电子,元素金属性越强。⑵意义衡量原子或离子失去电子的难易程度(3)元素第一电离能的变化规律规律:同一元素的逐级电离能是逐渐增大的(I1ⅢA的元素;第ⅤA元素>ⅥA元素(第ⅢA元素和第ⅥA元素出现反常)②同主族a、从左到右呈增大趋势(IA族最小,0族最大)从上到下,元素的第一电离能逐渐减小。(4)应用①判断元素金属性的强弱②根据电离能数据(看电离能数据是否发生突变)确定元素在化合物中的化合价I1越小,元素的金属性越强课堂练习下列说法正确的是()A.第3周期所含的元素中钠的第一电离能最小B.铝的第一电离...