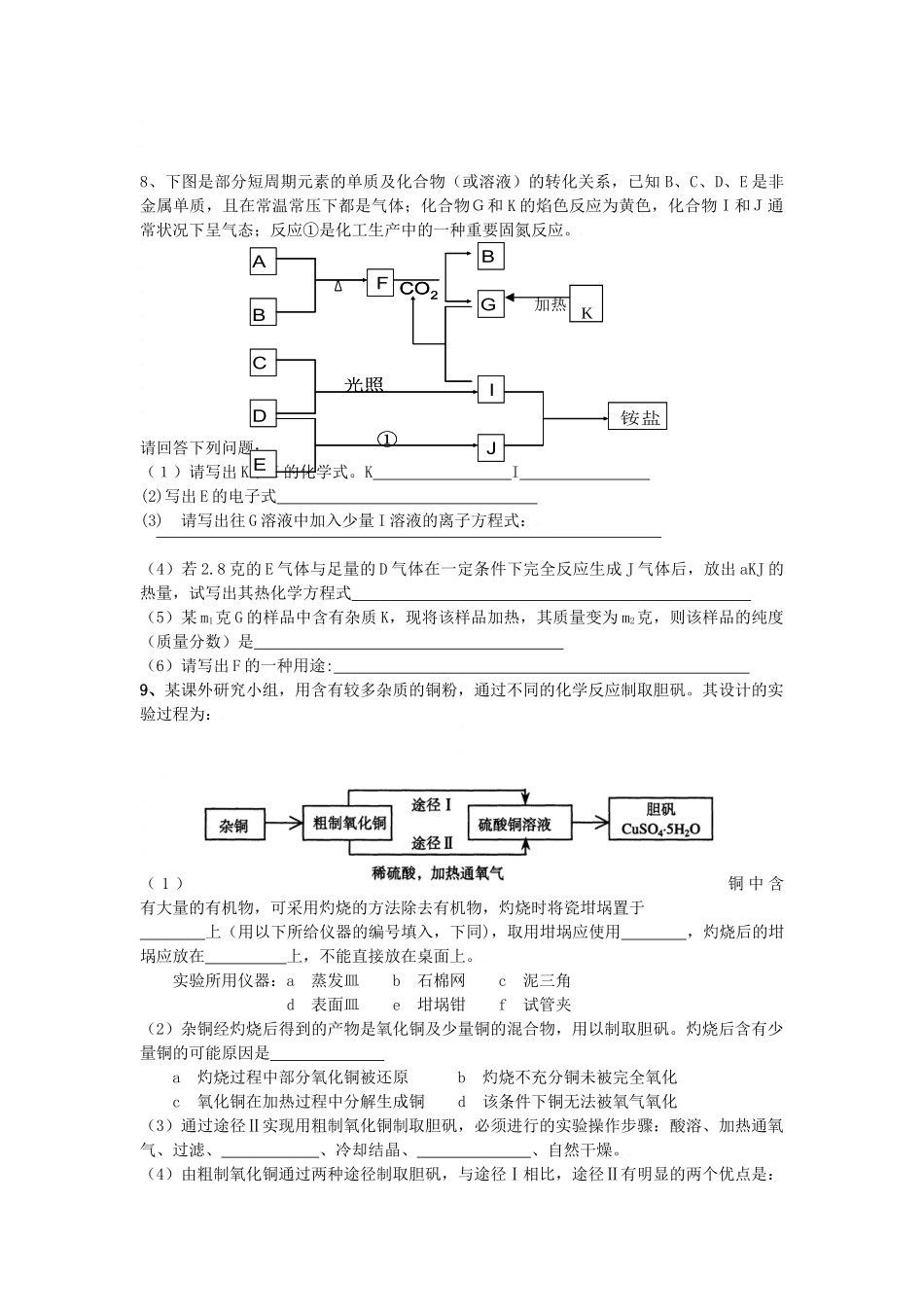
全国各地名校月考化学综合题汇总系列二1、现有几种离子阳离子Na+、Mg2+、A13+、Ba2+、NH4+阴离子OH—、C1—、NO3—、SO42—、HSO4—A、B、C、D、E是由它们组成的五种可溶于水的固体(每种离子只能用一次),分别取它们进行实验,结果如下:①将D与E的溶液混合加热,产生刺激性气味的气体;②将B与E的溶液混合,产生白色沉淀,向该沉淀中加入足量的稀硝酸,沉淀部分溶解;③向一定量的E溶液中逐滴加入C溶液,先无明显现象,后来产生白色沉淀,且该沉淀可溶于A溶液;且A溶液的焰色反应火焰为黄色。④D固体在一定温度下可以分解为水和另外两种均为空气主要成分的气体单质。根据上述信息回答下列问题:(1)根据以上条件推断并写出下列物质的化学式:A;B;C;D;E;(2)写出A溶液与E溶液恰好完全反应至溶液呈中性的离子方程式:。(3)写出D固体分解的化学方程式。2、某光卤石(KCl·MgCl2·6H2O)样品中含有不和NaOH溶液、盐酸反应的杂质。用测定镁的量,可以计算出KCl·MgCl2·6H2O的质量分数。有如下操作:A、称取a克样品,放入锥型瓶中加入适量的水溶解B、往锥型瓶中加入bmol/L的NaOH溶液100毫升(过量),震荡C、向步骤B锥型瓶中加入指示剂2-3滴D、用cmol/L的盐酸滴定过量的NaOH至终点,消耗盐酸V毫升(1)KCl·MgCl2·6H2O的质量分数是(2)如若你的操作中使用了指示剂,为使测定结果误差小,则指示剂是(填“酚酞”或者“甲基橙”),理由是。(3)如果在D的步骤中,滴定的盐酸滴加过量,则会使测定的结果。(填“偏低”、“偏高”、“没有影响”)3、下图中各物质均由常见元素(原子序数≤20)组成。已知A、B、K为单质,且在常温下A和K为气体,B为固体。D为常见的无色液体。I是一种常用的化肥,在其水溶液中滴加AgNO3溶液有不溶于稀HNO3的白色沉淀产生。J是一种实验室常用的干燥剂。它们的相互转化关系如右图所示(图中反应条件未列出)。请回答下列问题:(1)I的化学式为;J的电子式为(2)反应①的化学方程式为(3)F的水溶液与氯气反应的离子方程式为4、将一定体积的CO2通入VLNaOH溶液中,已知NaOH完全反应。在反应的溶液中加入足量石灰水,得到mg沉淀。(1)能否用上述数据确定参加反应的CO2的体积(标准状况)?____(“能”或“不能”),若能,列式表示为_____________。若不能,理由是____________________________。(2)能否用以上数据确定NaOH溶液的物质的量浓度?______(“能”或“不能”)。若在上述CO2和NaOH反应后的溶液不加入石灰水而是加入足量CaCl2溶液,结果得到了沉淀ng。设原NaOH溶液的物质的量浓度为c,则:①当n=m时,c=____________;②当n=0时,c=____________;③当n<m时,c=____________;5、写出除去下列物质中的杂质(括号内为杂质)时发生反应的化学方程式:(1)Na2CO3固体(NaHCO3);(2)SiO2(Al2O3)。6.计算题将4.96g某铜银合金溶于10mL13.0mol/L的浓硝酸中,待合金完全溶解后,收集到气体896mL(标准状况),并测得溶液的C(H+)=3mol/L。假设反应所得气体只可能是NO2、NO或它们的混合物,反应后溶液的体积仍为10mL。试计算:⑴被还原硝酸的物质的量。⑵合金中银的质量分数。⑶所得气体的组成(若为混合物,需算出各组成成分的体积)。7.某反应中反应物与生成物有:KClO3、K2SO4、H2C2O4、CO2、H2SO4、H2O、和一种未知物X。(1)已知KClO3在反应中得到电子,则该反应的还原剂是。(2)已知0.2molKClO3在反应中得到0.2mol电子生成X,则X的化学式为·(3)根据上述反应可推知.a.氧化性:KClO3>CO2b.氧化性:CO2>KClO3c.还原性:H2C2O4>Xd.还原性:X>H2C2O4(4)将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,并标出电子转移的方向和数目:+8、下图是部分短周期元素的单质及化合物(或溶液)的转化关系,已知B、C、D、E是非金属单质,且在常温常压下都是气体;化合物G和K的焰色反应为黄色,化合物I和J通常状况下呈气态;反应①是化工生产中的一种重要固氮反应。请回答下列问题:(1)请写出K和I的化学式。KI(2)写出E的电子...