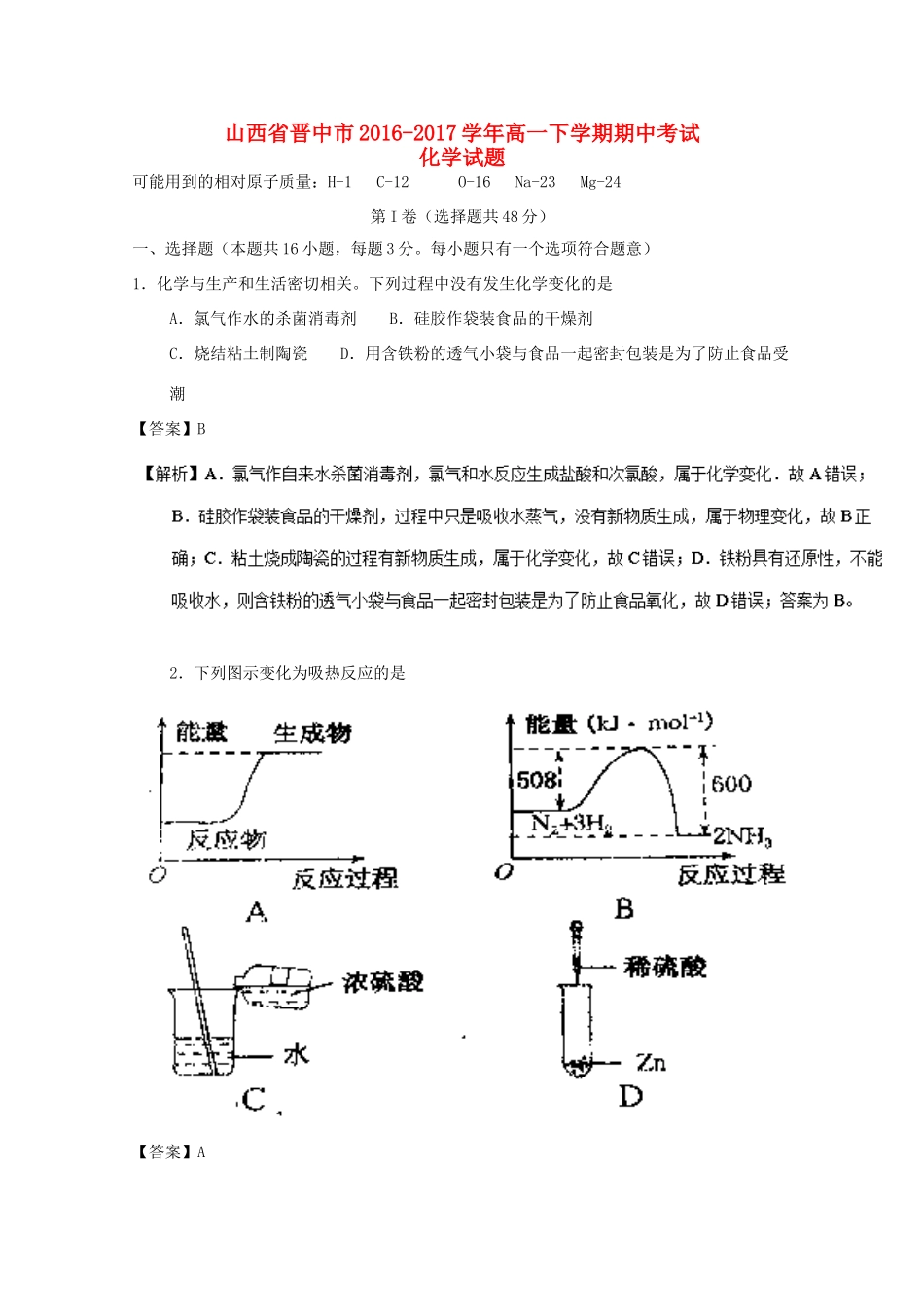
山西省晋中市2016-2017学年高一下学期期中考试化学试题可能用到的相对原子质量:H-1C-12O-16Na-23Mg-24第I卷(选择题共48分)一、选择题(本题共16小题,每题3分。每小题只有一个选项符合题意)1.化学与生产和生活密切相关。下列过程中没有发生化学变化的是A.氯气作水的杀菌消毒剂B.硅胶作袋装食品的干燥剂C.烧结粘土制陶瓷D.用含铁粉的透气小袋与食品一起密封包装是为了防止食品受潮【答案】B2.下列图示变化为吸热反应的是【答案】A【解析】A、反应物的总能量小于生成物的总能量,是吸热反应,A正确。B、反应物的总能量大于生成物的总能量是放热反应,B错误。C、浓硫酸溶于水虽放出热量,但其是物理变化,不属于放热反应,C错误。D、稀盐酸与锌反应放出热量,是放热反应,D错误。正确答案为A【点睛】判断一个反应是吸热反应还是放热反应,必须先判断其是否是化学反应。3.中国科学技术名词审定委员会己确定第116号元素Lv的名称为鉝。关于Lv的叙述错误的是A.原子序数116B.中子数177C.核外电子数116D.相对原子质量293【答案】D考点:考查元素原子的符号的表示及相互关系等知识。4.下列离子中半径最大的是A.Na+B.Mg2+C.O2-D.F-【答案】C【解析】试题分析:四种离子的核外电子排布相同,离子半径随原子序数的增大而减小,因此离子半径最大的是O2-,答案选C。【考点定位】考查微粒半径比较【名师点晴】微粒半径的大小比较:一看电子层数:同主族元素的微粒,电子层数越多,半径越大;二看核电荷数:在同周期中的原子,核电荷数越大,半径越小;三看电子数:在电子层数和核电荷数均相同时,电子数越多,半径越大。5.下列物质分类正确的是A.SO2、SiO2、CO均为酸性氧化物B.稀豆浆、硅酸、氯化铁溶液均为胶体C.烧碱、冰醋酸、蔗糖均为电解质D.盐水、水玻璃、氨水均为混合物【答案】D【点睛】理解酸性氧化物、胶体、电解质、混合物等概念是解题关键,能和碱反应生成盐和水的氧化物属于酸性氧化物;分散质粒子直径介于1nm-100nm的分散系属于胶体;电解质是在水溶液中或熔融状态下能导电的化合物;由两种或两种以上物质组成的物质属于混合物;根据以上概念分析。6.下列有关性质的比较,不能用元素周期律解释的是A.酸性:H2SO4>H3PO4B.非金属性:Cl>BrC.碱性:NaOH>Mg(OH)2D.热稳定性:Na2CO3>NaHCO3【答案】D【解析】试题分析:A、元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,非金属性:S>P,则酸性:H2SO4>H3PO4,能用元素周期律解释,A不选;B、同主族元素从上到下非金属性依次减弱,则非金属性:Cl>Br,能用元素周期律解释,B不选;C、元素的金属性越强,对应的最高价氧化物的水化物的碱性越强,金属性:Na>Mg,则碱性:NaOH>Mg(OH)2,能用元素周期律解释,C不选;D、碳酸氢盐易分解,碳酸盐难分解,所以热稳定性:Na2CO3>NaHCO3,不能用元素周期律解释,D正确,答案选D。考点:考查了元素周期律的理解与应用相关知识7.有关原电池的下列说法中正确的是A.在外电路中电子由正极流向负极B.在原电池中负极发生还原反应C.原电池工作时,阳离子向正极方向移动D.原电池中正极一定是不活泼金属【答案】C【解析】A.原电池中,失电子的电极作负极,电子由负极流向正极,故A错误;B.原电池中,失电子的电极作负极,负极失去电子发生氧化反应,故B错误;C.原电池放电时,溶液中阳离子向正极移动,阴离子向负极移动,故C正确;D.原电池中正极不一定是不活泼金属,如金属镁、铝、氢氧化钠构成的原电池中,金属镁是正极,故D错误;故选C。【点睛】明确原电池原理是解题关键,原电池是把化学能转变为电能的装置,原电池放电时,负极上失去电子发生氧化反应,正极上得电子发生还原反应,电子从负极沿导线流向正极,溶液中阳离子向正极移动,阴离子向负极移动,据此回答判断。8.下列指定反应的离子方程式正确的是A.将铜丝插入稀硝酸中:Cu+4H++2NO3-=Cu2++2NO2↑+H2OB.向Fe2(SO4)3溶液中加入过量铁粉:Fe3++Fe=2Fe2+C.向Al2(SO4)3溶液中加入过量氨水:Al3++3NH3·H2O=Al(OH)3↓+3NH4+D.向Na2SiO3溶液中滴加稀盐酸:NaSiO3+2H+=H2SiO3↓+2Na+...