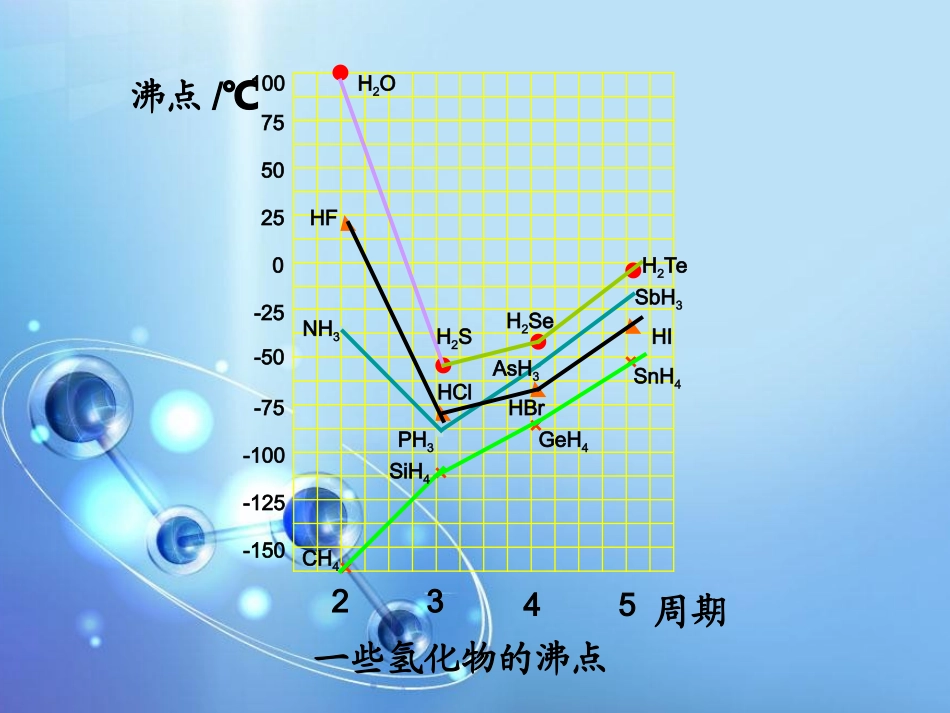
2-4分子间作用力与物质性质(第2课时)-150-125-100-75-50-2502550751002345××××CH4SiH4GeH4SnH4NH3PH3AsH3SbH3HFHClHBrHIH2OH2SH2SeH2Te沸点/℃周期一些氢化物的沸点比较H2O、H2S、H2Se、H2Te的熔沸点大小?思考:-150-125-100-75-50-2502550751002345H2OH2SH2SeH2Te沸点/℃周期1.定义:当氢原子与电负性大的X原子以共价键结合时,它们之间的共用电子对强烈地偏向X,使H几乎成为“裸露”的质子,这样相对显正电性的H与另一分子中相对显负电性的X(或Y)原子相接近并产生静电相互作用和一定程度的轨道的重叠作用,这种相互作用称氢键。2.强度:比分子间作用力稍强,但比化学键弱得多3.表示方法:用“XH▬••••••Y”表示OOHHHHOHHOOHHHH(1)氢键有方向性.氢原子尽可能处于X与Y的连线上(2)氢键有饱和性.Y有多少对孤对电子,最多能形成多少个氢键.4.氢键形成特点:5.氢键形成的条件(1).必须有H原子;(2).X与Y的电负性比较大,原子半径要求较小且要求有孤对电子对;(3).X、Y通常主要是O、N、F三种元素。6.氢键对物质的性质的影响1.形成分子间氢键,能使物质的熔点沸点升高,溶解度增大.如:水、氨、氟化氢熔沸点的异常增大.NH3和酒精易溶于水2.形成分子内氢键,能使物质的熔点沸点降低,溶解度减小.如:邻羟基苯甲酸熔点比对邻羟基苯甲酸.3.对溶液酸性的影响:溶液中的溶质形成氢键使酸性减弱4.形成的氢键越多,分子间作用力越大.如乙醇、乙二醇、丙三醇.⑦氢键只存在于固态、液态物质中,气态时无氢键。氢键存在的实例1.气态氢化物的熔点和沸点变化HF、H2O、NH3的异常情况2.有些物质可与水任意比互溶H2SO4、H3PO4、乙醇、甘油等3.水的密度与温度关系的特殊情况随温度升高,由小(0.9)变大(1.0)又变小.DNA双螺旋结构中的氢键碳酸酐酶对人体清除CO2的贡献练习1:下列微粒间不能形成氢键的是:A.CH4B.NH3C.NH4+D.OF2练习2:画出水分子与氨分子形成氢键的示意图.试解释为何NH3H•2O容易分解.AD【讨论】1、存在氢键的物质为何熔点、沸点相对较高?这是因为固体熔化或液体汽化时必须破坏分子间的氢键,从而消耗较多能量的缘故2、氯原子的电负性(3.0)与氮相近,为何NH3能形成氢键而HCl不形成氢键。这是因为Cl虽然电负性与N接近,但半径大(比N多了一层电子),所以只能形成很弱的氢键,可忽略。【讨论】(1)在液态水中是几个水分子通过氢键结合起来(H2O)n;在固态冰中,是以大范围地氢键互相联结,形成相当疏松的晶体,从而在结构中有许多空隙,造成体积膨胀,密度减小,因此冰能浮在水面上◆4.热胀冷缩是一种物理现象,但水结冰时体积膨胀,即ρ冰<ρ水,为什么?(2)当冰熔化时,水分子不能最大程度的形成氢键,因而占有体积减小,密度增大.(3)液态水时,温度升高,水的热运动加剧,体积膨胀密度变小.(4)在40时,(2)(3)两种变化达到平衡,因而40时水的密度最大.小结:1.1.氢键的概念氢键的概念2.2.氢键的表示方式氢键的表示方式3.3.氢键形成条件氢键形成条件4.4.氢键对物质的性质的影响氢键对物质的性质的影响•作业:•书P642.3.4.5完成同步练习