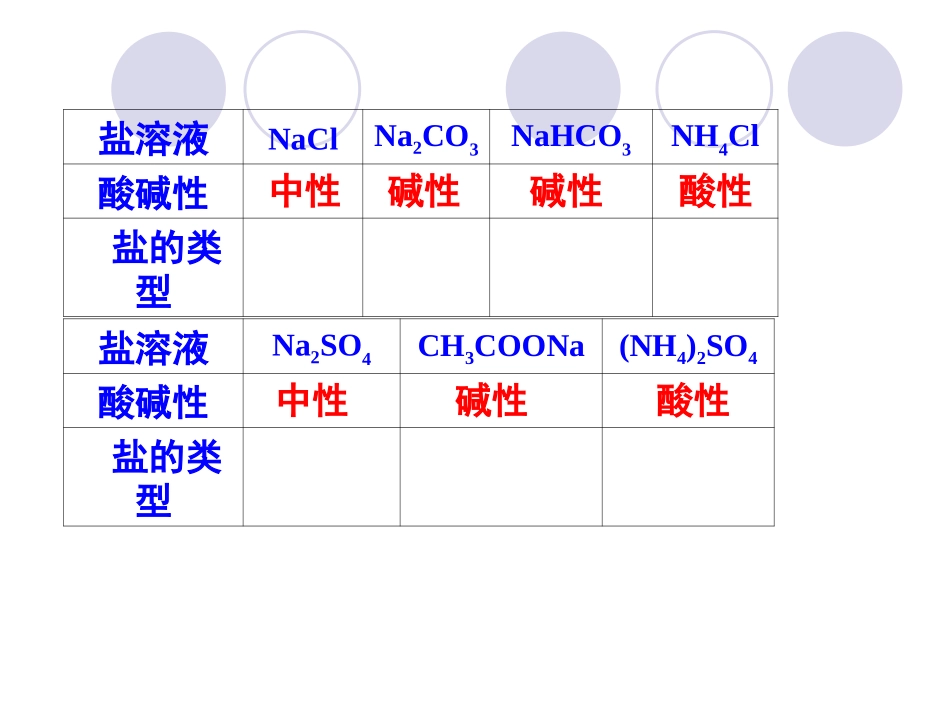
第三节盐类水解请同学们根据所做实验:探究盐溶液酸碱性,填写科学探究的表格,并回答。3分钟盐溶液NaClNa2CO3NaHCO3NH4Cl酸碱性盐的类型盐溶液Na2SO4CH3COONa(NH4)2SO4酸碱性盐的类型中性中性碱性碱性碱性酸性酸性盐溶液NaClNa2CO3NaHCO3NH4Cl酸碱性中性碱性碱性酸性盐的类型盐溶液Na2SO4CH3COONa(NH4)2SO4酸碱性中性碱性酸性盐的类型强酸强碱盐强酸弱碱盐强酸弱碱盐强碱弱酸盐强碱弱酸盐强碱弱酸盐强酸强碱盐分析上述实验结果,归纳盐溶液酸碱性与盐类型的关系盐的类型强酸强碱盐强酸弱碱盐强碱弱酸盐溶液的酸碱性碱性酸性中性思考与交流一1、NH4Cl溶液显酸性,说明什么问题?2、NH4Cl溶液中的H+和OH-来自于什么物质?3、溶液呈酸碱性的实质是什么?水电离出的H+和OH-相等吗?4、NH4Cl固体溶于水为何造成了C(H+)、C(OH-)不相等?对水的电离平衡造成了什么影响?5、请你解释CH3COONa溶液为什么为碱性?NaCl溶液为中性?6、什么叫盐类的水解?5.规律:2.条件:破坏水的电离平衡,促进水的电离1.定义:一、盐类的水解溶液中盐电离出的阳离子或阴离子跟水电离出的OH-或H+结合生成弱电解质的反应4.特点:水解吸热,反应程度一般很微弱有弱才水解,无弱不水解谁强显谁性,同强显中性3.实质:盐中含有弱酸酸根离子或弱碱阳离子6.水解方程式和离子方程式的书写(1)方程式中一般用“⇌”表示(2)通常不标“↑”“↓”符号,生成物如(H2CO3、NH3.H2O)也不写分解产物(3)多元弱酸根的水解方程式一般只写第一步(4)书写弱碱阳离子的水解时一步到位一.盐类的水解注意特殊:后边再讲解,请留下空白以后好记笔记1、判断下列盐溶液的酸碱性,发生水解的写出水解离子方程式。NaF、CuSO4、KI、NH4NO3、CsCl、K2SF-+H2O⇌HF+OH-Cu2++2H2O⇌Cu(OH)2+2H+S2-+H2O⇌HS-+OH-NH4++H2O⇌NH3·H2O+H+练习中性酸性中性酸性中性碱性2.下列方程式是水解方程式的是:A.H2O+H2OH⇌3O++OH-B.HS-+H2OS⇌2-+H3O+C.CH3COO-+H2OCH⇌3COOH+OH-D.CO32-+H2OHCO⇌3-+OH-练习C、D思考与讨论:1、PH为3的盐酸、PH为12的氢氧化钡溶液中水电离出的氢离子浓度为多少?2、PH为3的CuSO4溶液、PH为12的NaCN溶液中水电离出的氢离子浓度为多少?练习、常温下,有四种溶液分别为:①pH=0的盐酸;(H+)②0.1mol·L-1的NaOH溶液;(OH-)③pH=10的醋酸钠溶液;(OH-)④pH=5的NH4Cl溶液;(H+)下列四选项中数据为上述四溶液中水电离的括号中离子浓度大小比,其中符合①∶②∶③∶④的是()A、1:10:1010:105B、1:10:105:1010C、0:1:10:105D、1:10:1010:109D盐溶液水解的本质破坏水的电离平衡,促进水的电离。1、请填写P54科学探究,分析总结出盐溶于水酸碱性的判定?2、已知:物质的量浓度相同的NaF和CH3COONa溶液的pH依次为9、10。(1)谁水解的程度大?(2)已知CH3COOH的酸性弱于HF,则该类盐水解生成的弱酸酸性强弱与盐水解的程度有什么关系?思考与交流一课时二解释:水解生成的酸或碱越弱,即Ka或Kb越小,则说明弱碱阳离子和H2O所电离出来的OH-结合的能力越,或说明弱酸酸根离子与H2O所电离出来的H+结合的能力越,则水解的程度越。越弱越水解!强强大二.影响盐类水解的因素(1)内因:盐本身的性质即越弱越水解练习1:物质的量浓度相同的三种盐NaX、NaY、NaZ的溶液,其pH依次为8、9、10,则HX、HY、HZ的酸性由强到弱的顺序是。思考与交流二请你用化学平衡理论来解释下列外界条件的改变对盐类的水解的影响(2)外因:温度、浓度及其他电解质的加入平衡移动方向c(NH4+)c(NH3·H2O)c(H+)pHc(OH-)水解程度升温加水加少量NH4Cl加少量浓盐酸加固体NaOH锌粉NH4++H2ONH⇌3·H2O+H+正向正向增大减小正向逆向正向正向减小减小减小减小减小减小减小减小减小减小减小增大增大增大增大增大增大增大增大增大减小减小减小增大增大增大增大增大思考讨论请设计实验证明温度升高能促进CH3COONa的电离?思考与交流三(1)向NH4Cl溶加入少量CH3COONa固体,对NH4+的水解有何影响?(2)向CH3COONa溶液中加入少量NH4Cl固体,对CH3COO-的水解有何影响?(3)CH3COONH4溶液中,CH3COO-、NH4+的水解与等浓度CH3COONa溶液、NH4Cl溶液中对应离子的水解有何分别?(4)不做实验,...