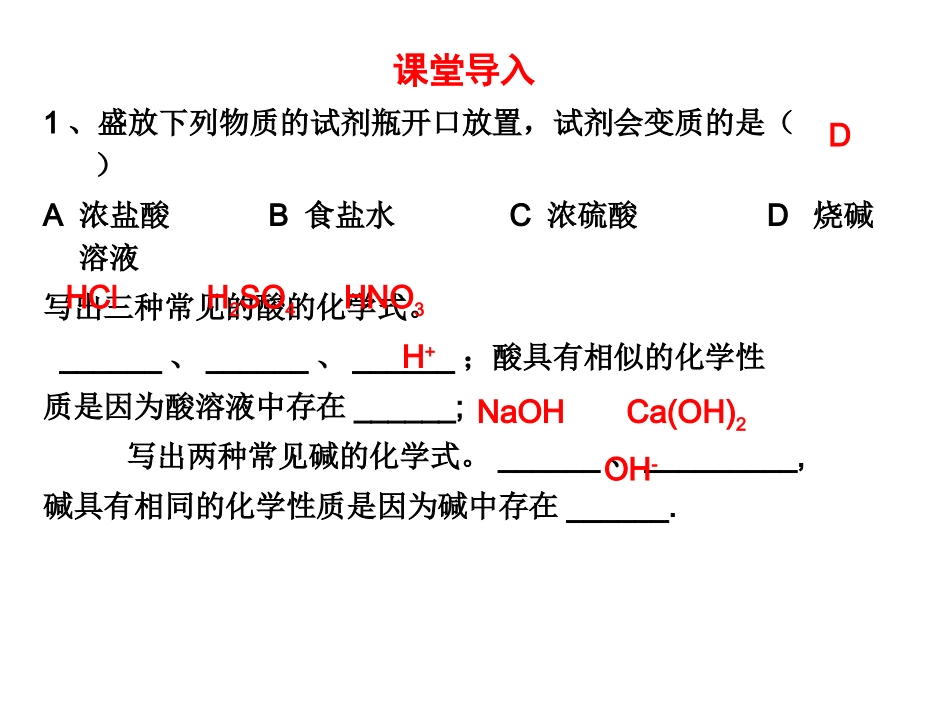
课题2酸和碱的中和反应(1)【学习目标】1、认识中和反应以及中和反应在实际中的应用;2、认识盐和它的结构。【重点】1、中和反应的判断、中和反应及其应用;2、盐的结构特点【难点】盐的构成特点、从微观角度认识中和反应的实质课堂导入1、盛放下列物质的试剂瓶开口放置,试剂会变质的是()A浓盐酸B食盐水C浓硫酸D烧碱溶液写出三种常见的酸的化学式。______、______、______;酸具有相似的化学性质是因为酸溶液中存在______;写出两种常见碱的化学式。______、_________,碱具有相同的化学性质是因为碱中存在______.HClH2SO4HNO3H+NaOHCa(OH)2OH-D知识点1:中和反应【探究实验】酸和碱能否发生反应?实验步骤实验现象盛NaOH溶液的小烧杯中加入稀盐酸(1)在烧杯中倒入10毫升氢氧化钠溶液,滴入几滴无色酚酞溶液;(2)再用滴管慢慢滴入稀盐酸,并不断搅拌。溶液呈___色;溶液变为___色,没有明显现象实验结论:;化学方程式:。红无NaOH+HCl=NaCl+H2O酸和碱发生化学反应实验结论:酸和碱能反应为什么要加入酚酞指示剂?借以判断反应有无发生什么时候酸和碱恰好完全反应?溶液刚好由红色变为无色思考:【小组合作学习1】氢氧化钠(碱)和稀盐酸(酸)发生了反应,生成NaOH+HCl===NaCl+H2O碱酸水?盐金属离子酸根离子盐==金属离子+酸根离子【自主学习】阅读教材第60页,了解中和反应和盐的概念。(1)中和反应:____和____生成_____和____的反应。[小组讨论2](2)中和反应的实质:。反应前反应后H++OH-==H2O酸碱盐水NaOH+HCl=NaCl+H2O碱酸盐水知识应用【练习1】(1)下列物质中属于酸的是;属于碱的是;属于盐的是.①KOHH②2OHNO③3NH④3·H2OCa(OH)⑤2CaCO⑥3(2)下列各组物质,要借助指示剂才能判断反应的发生的是______A石灰石与盐酸BCO2+H2OC氧化铜和盐酸DNaOH+HCl(3)写出下列反应的化学方程式,其中属于中和反应的是_________.①烧碱溶液与稀盐酸______________________②氢氧化钾与硝酸_______________________③把二氧化硫通入烧碱溶液中_______________________④氧化铁与盐酸______________________BD⑥①②NaOH+HCl=NaCl+H2OKOH+HNO3=KNO3+H2OFe2O3+6HCl=2FeCl3+3H2O2NaOH+SO2=Na2SO3+2H2O③①④⑤知识点2:中和反应在实际中的应用【自主学习】阅读材料第61页,了解中和反应在生活,生产中的运用。1、中和酸性土壤用(化学式)__________2、处理工厂的酸性废水Ca(OH)2+H2SO4=__________3、氢氧化铝治疗胃酸过多的病人(化学方程式)__________________________.4、被蚊虫叮咬可涂__________,可以减轻痛痒。5、在运用上除考虑物质的性质外,还需考虑哪些因素?1)中和酸性土壤为何不选择氢氧化钠?2)治疗胃酸过多为何不选择NaOH、KOH、Ca(OH)2及CaO等物质?Ca(OH)2CaSO4+2H2OAl(OH)3+3HCl=AlCl3+3H2O氨水、肥皂水氢氧化钠具有强的腐蚀性,会腐蚀土壤。这些物质都具有腐蚀性,会对人体造成伤害。•【练习2】•(1)(2)•【自主评价】•(1)(2)(3)(4)(5)BADCBDB学完本节课你知道了什么?学完本节课你知道了什么?2..酸和碱能发生中和反应,生成盐和水。3.酸碱中和反应在生活和生产中有广泛的应用。1.盐是由金属离子和酸根离子构成的化合物。课题2酸和碱的中和反应(2)【学习目标】1、了解溶液的酸碱度及测定方法;2、了解酸碱度对生命活动和农作物的影响。【重点】1、溶液酸碱度的表示和简单测定方法;2、溶液酸碱度与生产生活的关系【难点】1、溶液pH大小与溶液酸碱性强弱的关系;2、pH变化曲线。课堂导入1、2、知识点1:溶液酸碱度的表示法----pH【自主学习】阅读教材第61-62页,了解溶液酸碱度的表示法。1.pH是表示溶液的酸碱性的强弱程度(即溶液______)的一种方法。2.pH范围是_______________.3.常见溶液酸碱度与pH的关系酸性中性碱性pH1)酸性越强,pH______2)碱性越强,pH______D酸碱度0-14越小<7=7>7B越大练习1:1、常见物质中酸性最强的是()A橙汁pH=3B食盐水pH=7C牙膏pH=8D肥皂水pH=10(2)向pH=11的溶液中滴加石蕊试剂,溶液呈()A紫色B红色C蓝色D无色(3)部分食物的近似pH如下:番茄4.0~4.4,苹果2.9~3.3,柑橘3.0~4.0,鸡蛋清7.6~8.0,当人体...