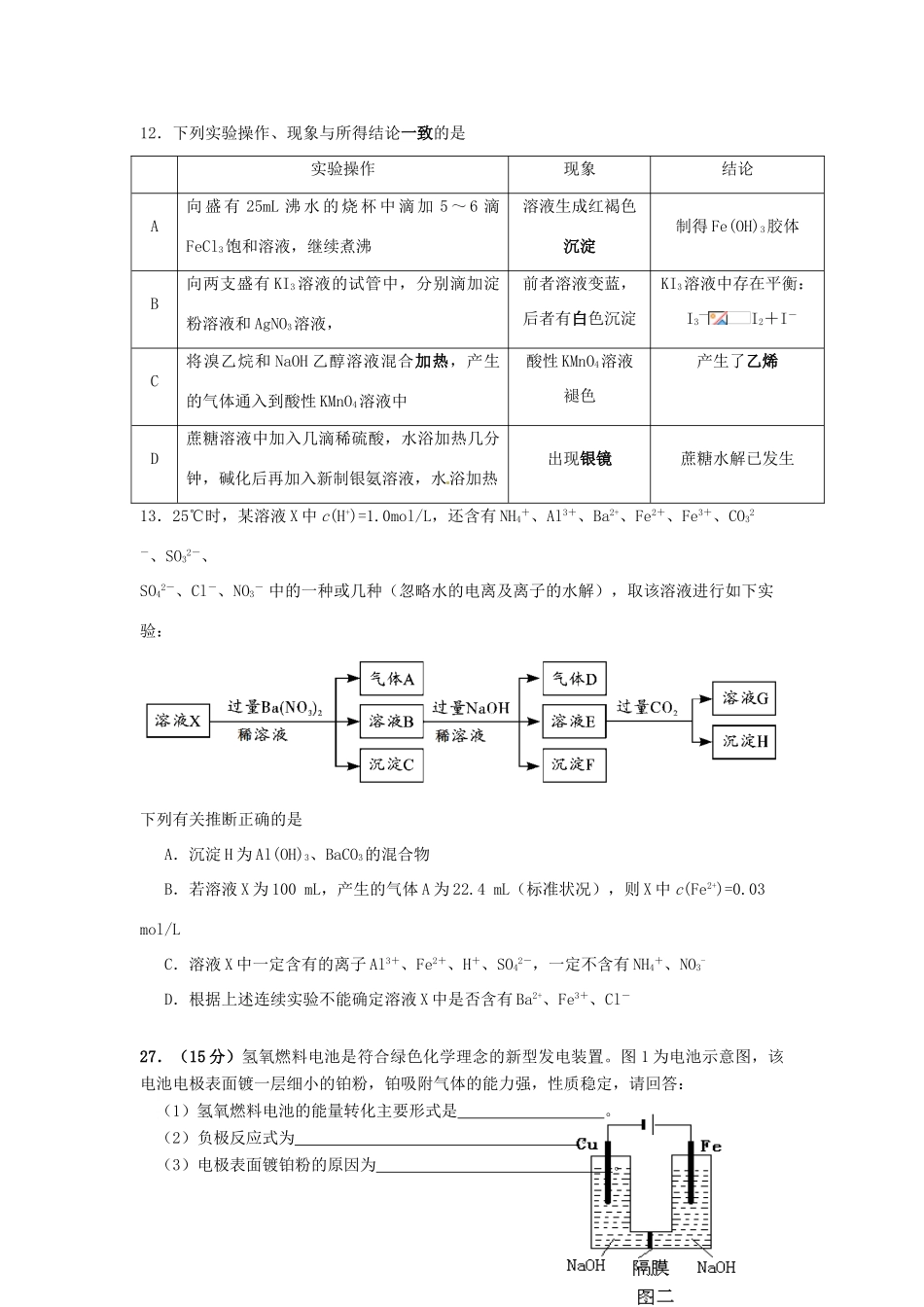
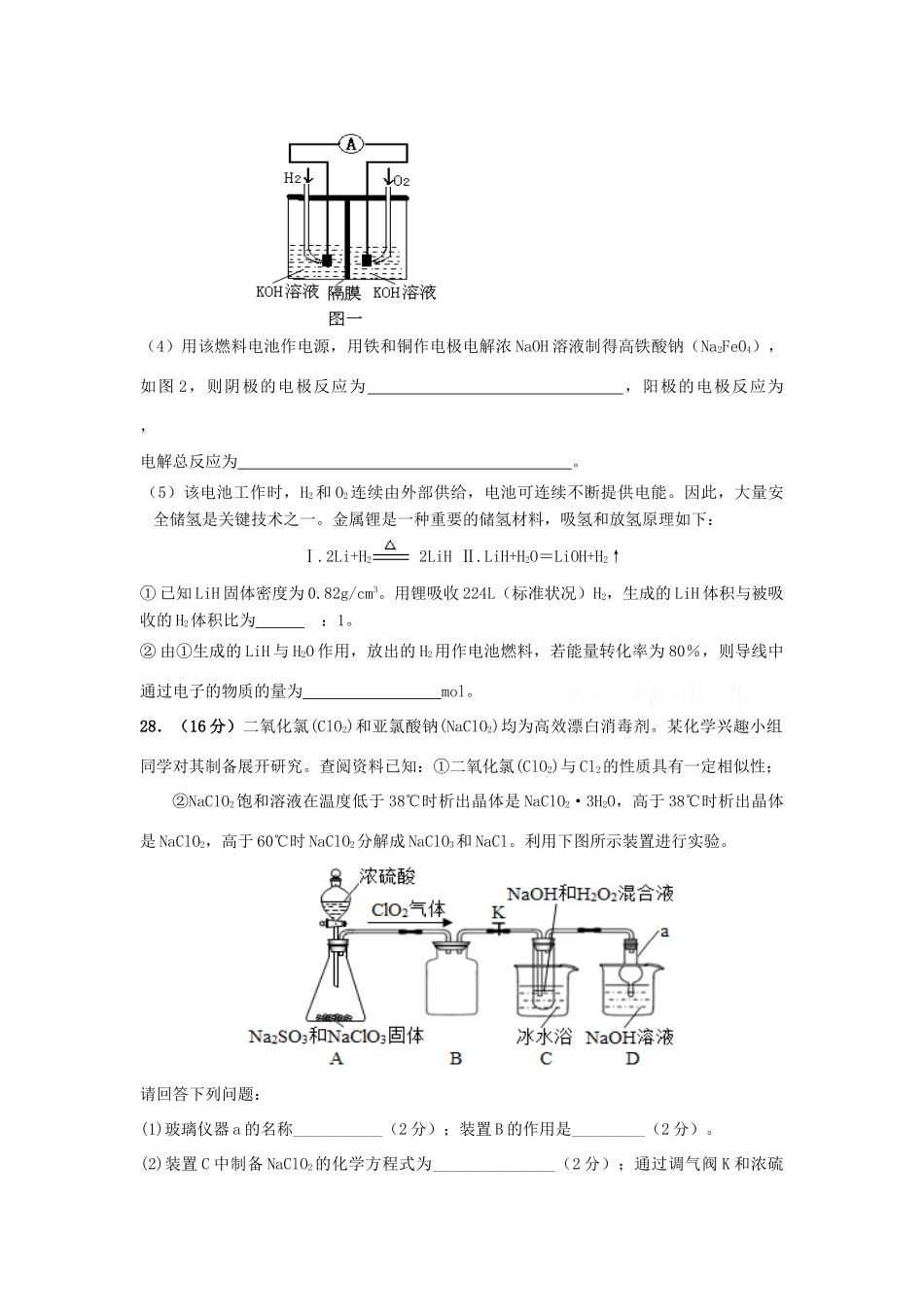
四川省攀枝花市第十五中学校2021届高三化学上学期第6次周考试题可能用到的相对原子质量:H—1;C—12;Cl—35.5;O—16;N—14;Na—23;Li—7;Cu—64一、选择题:(每小题6分)在每小题给出的四个选项中,只有一项是符合题目要求的。7.宋代《千里江山图》描绘了山清水秀的美丽景色,历经千年色彩依然,其中绿色来自孔雀石颜料(主要成分为Cu(OH)2·CuCO3),青色来自蓝铜矿颜料(主要成分为Cu(OH)2·2CuCO3)。下列说法错误的是A.保存《千里江山图》需控制温度和湿度B.孔雀石、蓝铜矿颜料不易被空气氧化C.孔雀石、蓝铜矿颜料耐酸耐碱D.Cu(OH)2·CuCO3中铜的质量分数高于Cu(OH)2·2CuCO38.在溶液中加入足量Na2O2后仍能大量共存的离子组是A.K+、AlO2-、Cl-、SO42-B.NH4+、Ba2+、Cl-、NO3-C.Ca2+、Mg2+、NO3-、HCO3-D.Na+、Cl-、CO32-、SO32-9.用NA表示阿伏加德罗常数的值,下列叙述正确的是()A.标准状况下,每生成2.24LO2,转移的电子数一定为0.4NA.B.标准状况下,22.4LC2H6O中含C-H键5NAC.1mol冰醋酸和lmol乙醇在加热和浓硫酸条件下充分反应生成的水分子数为NAD.KClO3+6HCl==KCl+3Cl2↑+3H2O反应中,生成3molCl2时,转移的电子数目为5NA10.下列离子方程式书写正确的是A澄清石灰水与少量小苏打溶液混合:Ca2+十OH-+HCO3-===CaCO3↓+H2OBFeCl2溶液中通入Cl2:Fe2++Cl2==Fe3++2Cl-CFeS固体放人稀硝酸溶液中:FeS+2H+==Fe2++H2S↑DAlCl3溶液中加入过量氨水:Al3++4OH-==AlO2-+2H2O11.Mg—AgCl电池是一种以海水为电解质溶液的水激活电池。下列叙述错误的是A.负极反应式为Mg-2e-=Mg2+B.正极反应式为Ag++e-=AgC.电池放电时Cl-由正极向负极迁移D.负极会发生副反应Mg+2H2O=Mg(OH)2+H2↑12.下列实验操作、现象与所得结论一致的是实验操作现象结论A向盛有25mL沸水的烧杯中滴加5~6滴FeCl3饱和溶液,继续煮沸溶液生成红褐色沉淀制得Fe(OH)3胶体B向两支盛有KI3溶液的试管中,分别滴加淀粉溶液和AgNO3溶液,前者溶液变蓝,后者有白色沉淀KI3溶液中存在平衡:I3—I2+I-C将溴乙烷和NaOH乙醇溶液混合加热,产生的气体通入到酸性KMnO4溶液中酸性KMnO4溶液褪色产生了乙烯D蔗糖溶液中加入几滴稀硫酸,水浴加热几分钟,碱化后再加入新制银氨溶液,水浴加热出现银镜蔗糖水解已发生13.25℃时,某溶液X中c(H+)=1.0mol/L,还含有NH4+、Al3+、Ba2+、Fe2+、Fe3+、CO32-、SO32-、SO42-、Cl-、NO3-中的一种或几种(忽略水的电离及离子的水解),取该溶液进行如下实验:下列有关推断正确的是A.沉淀H为Al(OH)3、BaCO3的混合物B.若溶液X为100mL,产生的气体A为22.4mL(标准状况),则X中c(Fe2+)=0.03mol/LC.溶液X中一定含有的离子Al3+、Fe2+、H+、SO42-,一定不含有NH4+、NO3-D.根据上述连续实验不能确定溶液X中是否含有Ba2+、Fe3+、Cl-27.(15分)氢氧燃料电池是符合绿色化学理念的新型发电装置。图1为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:(1)氢氧燃料电池的能量转化主要形式是。(2)负极反应式为。(3)电极表面镀铂粉的原因为。(4)用该燃料电池作电源,用铁和铜作电极电解浓NaOH溶液制得高铁酸钠(Na2FeO4),如图2,则阴极的电极反应为,阳极的电极反应为,电解总反应为。(5)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能。因此,大量安全储氢是关键技术之一。金属锂是一种重要的储氢材料,吸氢和放氢原理如下:Ⅰ.2Li+H22LiHⅡ.LiH+H2O=LiOH+H2↑①已知LiH固体密度为0.82g/cm3。用锂吸收224L(标准状况)H2,生成的LiH体积与被吸收的H2体积比为:1。②由①生成的LiH与H2O作用,放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为mol。28.(16分)二氧化氯(ClO2)和亚氯酸钠(NaClO2)均为高效漂白消毒剂。某化学兴趣小组同学对其制备展开研究。查阅资料已知:①二氧化氯(ClO2)与Cl2的性质具有一定相似性;②NaClO2饱和溶液在温度低于38℃时析出晶体是NaClO2·3H2O,高于38℃时析出晶体是NaClO2,高于60℃时NaClO2分解成NaC...