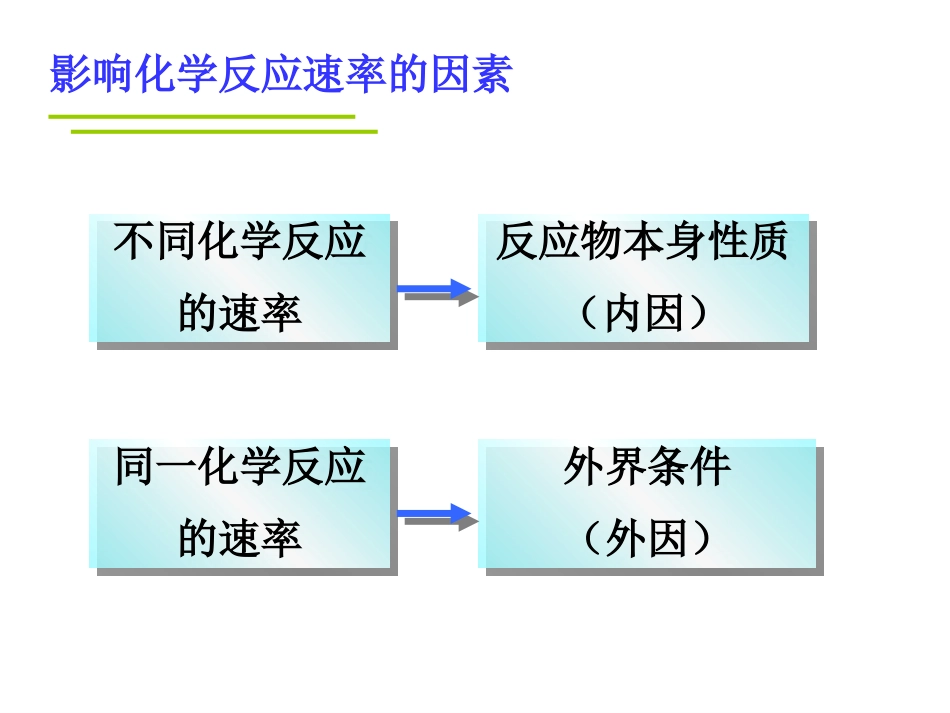
第二章化学反应速率和化学平衡第二节影响化学反应速率的因素(1)镁与盐酸反应比铁与盐酸反应产生H2的速率快。(2)硫在纯氧中比在空气中燃烧剧烈。(3)新鲜的水果和食物保存在冰箱里能存放得更久。(4)香蕉采摘的时候并不是完全熟的,常用乙烯作为它的催熟剂。(5)煤粉比煤块更容易燃烧。思考与交流用化学的观点解释下列事实:影响化学反应速率的因素不同化学反应的速率不同化学反应的速率反应物本身性质(内因)反应物本身性质(内因)同一化学反应的速率同一化学反应的速率外界条件(外因)外界条件(外因)实验2-2浓度对化学反应速率的影响0.01mol/LKMnO4溶液0.1mol/LH2C2O4溶液0.2mol/LH2C2O4溶液快慢2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O酸性KMnO4溶液和H2C2O4溶液反应的化学方程式:其他条件不变时,增大反应物的浓度,反应速率;反之,减小反应物的浓度,反应速率。结论:增大减小【牛刀小试】在2L的密闭容器中加入1molC和mol水蒸气,发生反应:C(s)+H2O(g)=CO(g)+H2(g)。(1)其他条件不变,加入1molH2O(g),反应速率。(2)其他条件不变,加入1molC(s),反应速率。增大不变固体和纯液体的浓度是一个常数,所以增加这些物质的物质的量,不会影响反应速率。碰撞理论解释浓度对化学反应速率的影响结论:同一反应,活化分子百分数是一定的,增加反应物的浓度,单位体积内活化分子数目增多,有效碰撞次数增加,反应速率加快。改变压强对以下反应是否有影响?(1)加热高锰酸钾粉末制备氧气(2)H2O2与MnO2反应制备氧气(3)SO2与O2反应对于有气体参加的反应,当其他条件不变时,增大压强(减小容器体积),相当于,反应速率。反之,减小压强(扩大容器体积),反应速率。由于压强对固体、液体的体积几乎无影响,因此,对无气体参加的反应,压强对反应速率的影响可忽略不计。压强对化学反应速率的影响增大反应物的浓度增大减小压强对反应速率的影响实际上是通过浓度影响的压强增大→单位体积内反应物浓度增大→活化分子数增加→有效碰撞次数增加压强对化学反应速率的影响碰撞理论解释→反应速率增大【思考】1、在N2+3H2=2NH3中,当其他条件不变时,以下几种增大压强的措施,对反应速率的影响为:(1)压缩容器体积,气体浓度,反应速率。(2)容器体积不变,充入N2或H2,气体浓度,反应速率。(3)容器体积不变,充入He,气体浓度,反应速率。2、在N2+3H2=2NH3中,当其他条件不变时,保持体系压强不变,充入He,反应速率。增大增大增大增大不变不变减小解析:V不变,c不变,v不变解析:V增大,c减小,v减小总结压强对反应速率的影响实际上是通过浓度影响的,若压强改变后,浓度未变,其化学反应速率不变。1、无气体参加的反应,压强对反应速率无影响2、恒温缩小反应容器体积,浓度增大,反应速率增大3、恒温恒容时,充入反应气体,反应速率增大充入惰性气体,反应速率不变4、恒温恒压时,充入惰性气体,反应速率减小。在C(s)+CO2(g)=2CO(g)的反应中,现采取下列措施:(1)增大压强;(2)增加碳的量(3)通入CO2;(4)恒容下充入N2;(5)恒压下充入N2哪些措施能够使反应速率增大?为什么?答案:(1)(3)巩固练习探究实验5mL0.1mol/L的H2SO4+5mL0.1mol/LNa2S2O3热水冷水快慢Na2S2O3+H2SO4=Na2SO4+SO2+S↓+H2O温度对化学反应速率的影响其它条件相同时,升高温度,反应速率;反之,降低温度,反应速率。结论:增大减小温度对化学反应速率的影响碰撞理论解释升高温度,一部分非活化分子吸收能量转化为活化分子,活化分子百分数提高,有效碰撞频率变大,故反应速率增大。2H2O22H2O+O2↑MnO2【结论】其它条件不变时,选用适当的催化剂可以改变反应速率。催化剂对化学反应速率的影响探究实验能量反应过程E1E2反应物生成物活化分子活化能活化分子变成生成物分子放出的能量反应热没加催化剂加了催化剂催化剂对化学反应速率的影响温度对化学反应速率的影响碰撞理论解释加入催化剂,降低了活化能,使一些能量不太高的分子也转化为活化分子,活化分子百分数提高,有效碰撞频率变大,故反应速率增大。【探究1】设计实验比较在2mL5%的H2O2中加入FeCl3和CuSO4溶液各1mL,比较二者...