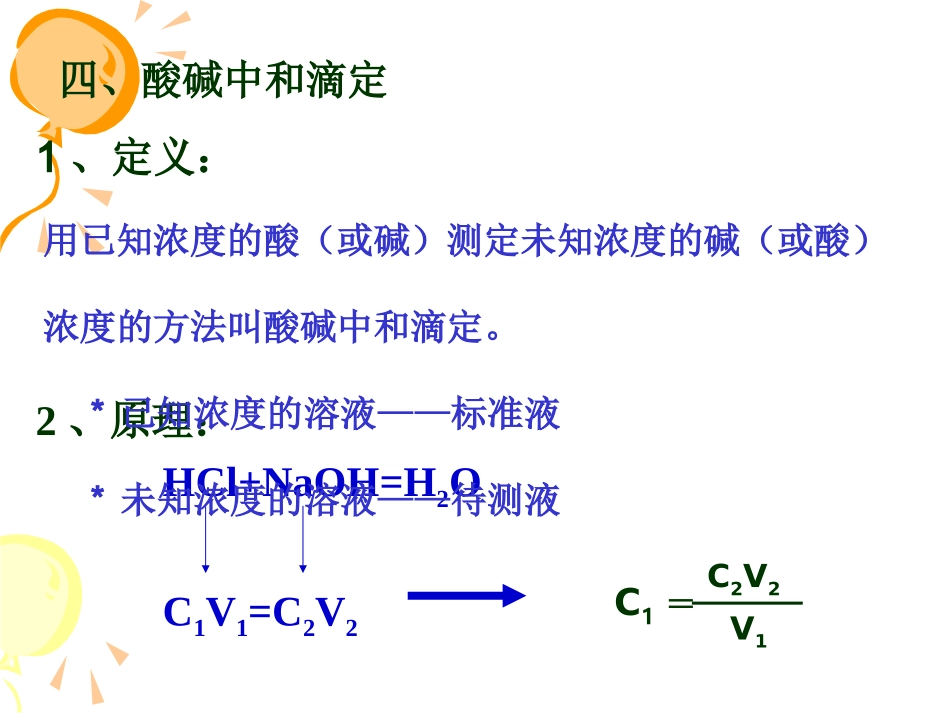
沪教版高二上期2019.3酸碱中和滴定酸碱中和滴定第一课时第一课时第十章第三节2、原理:HCl+NaOH=H2OC1V1=C2V2C1=C2V2V11、定义:四、酸碱中和滴定用已知浓度的酸(或碱)测定未知浓度的碱(或酸)浓度的方法叫酸碱中和滴定。*已知浓度的溶液——标准液*未知浓度的溶液——待测液[[课堂练习课堂练习]]用0.1100mol/L的HCl溶液滴定20.00mL未知浓度的NaOH溶液,滴定完成时,用去HCl溶液25.00mL。通过中和滴定测得NaOH溶液的物质的量浓度是多少?0.1375mol/L[思考]把上题中HCl改成H2SO4,则NaOH的物质的量浓度为多少?33、实验仪器、实验仪器酸式滴定管碱式滴定管铁架台滴定管夹锥形瓶你知道酸碱滴定管的区别吗?酸碱中和滴定实验:1、仪器滴定管的使用酸式滴定管:碱式滴定管:装酸,腐蚀性溶液(碱溶液腐蚀会玻璃旋塞)装碱(胶皮管)铁架台滴定管夹锥形瓶烧杯滴定管常见量器简介量筒、滴定管、移液管(1)量筒:粗量仪,10mL量筒最小分刻度为0.1mL读数精确到0.1mL,无“O”刻度(2)滴定管类型:酸式滴定管和碱式滴定管标识:标有温度、规格、刻度(“0”刻度在最高点)(常用规格:25mL、50mL)最小分刻度:0.1mL,读数精确到0.01mL(精量仪可估读一位,粗量仪不能估读)思考:25mL量程滴定管只能盛放25mL的液体吗?滴定管:刻度:0刻度在上(与量筒不同)取液:在刻度范围内取液,不够再装,液体不能放完。放液:酸式:旋转旋塞碱式:挤压玻璃球例1、下列所述仪器“0”刻度位置正确的是()A.在量筒的上端B.在滴定管上端C.容量瓶上端B练1:量取25.00mL,KMnO4溶液可选用仪器()A.50mL量筒,B.100mL量筒C.50mL酸式滴定管,D.50mL碱式滴定管C练2:50ml的滴定管盛有溶液,液面恰好在20.00处,若把滴定管中溶液全部排出,则体积()A、等于30B、等于20C、大于30D、小于30C2、药品:指示剂(甲基橙或酚酞)已知酸(碱)、未知碱(酸)3、滴定的关键:准确测定两溶液的体积准确判断滴定终点44、指示剂的选择及滴定终点的判断、指示剂的选择及滴定终点的判断(1)指示剂甲基橙3.1-4.4红-橙-黄酚酞8-10无-粉红-红(2)滴定终点的判断不用石蕊作指示剂原因:颜色变化不明显指示剂的颜色发生突变并且半分钟不变色即达到滴定终点,终点的判断是滴定实验是否成功的关键。注意:滴定终点时溶液的pH值应尽可能与指示剂的变色范围一致。5、操作:(1)滴前准备:①检查漏不漏活塞是否灵活橡皮,玻璃球②洗涤仪器滴定管:自来水,蒸馏水,盛装液(润洗)锥形瓶:自来水,蒸馏水(不用盛装液洗)(2)装液:标准液:装入滴定管中(排、调、记)未知液:锥形瓶中(加指示剂2~3滴)(3)滴定:右手:持锥形瓶左手:控制旋塞(或玻璃球)眼睛:注视锥形瓶内溶液颜色的变化注意:①先快后慢②滴定终点:半分钟不褪色(4)读数:平视(小数点后两位)(5)重复2~3次(6)计算:取平均值练3:某学生中和滴定实验的过程如下:(1)取一支碱式滴定管,②用蒸馏水洗净,③加入待测NaOH溶液,④记录液面刻度的读数,⑤用酸式滴定管精确放出一定量标准酸液,⑥置于用标准酸液洗涤过的锥形瓶中,⑦加入2滴酚酞试剂,⑧开始滴定,先慢后快,边滴边摇荡,⑨边注视滴定管液面变化,⑩小心滴到溶液由无色变为粉红色时,即停止滴定,⑾记录液面读数,⑿重复滴定,根据两次读数得出NaOH的体积21ml上述学生操作错误的有(填序号)3、6、8、9、10、12课后作业课后作业一、预习一、预习““酸碱中和滴定的误差分析酸碱中和滴定的误差分析””并完成练习册上相关预习内容并完成练习册上相关预习内容二、完成练习册中中和滴定的课堂练习二、完成练习册中中和滴定的课堂练习