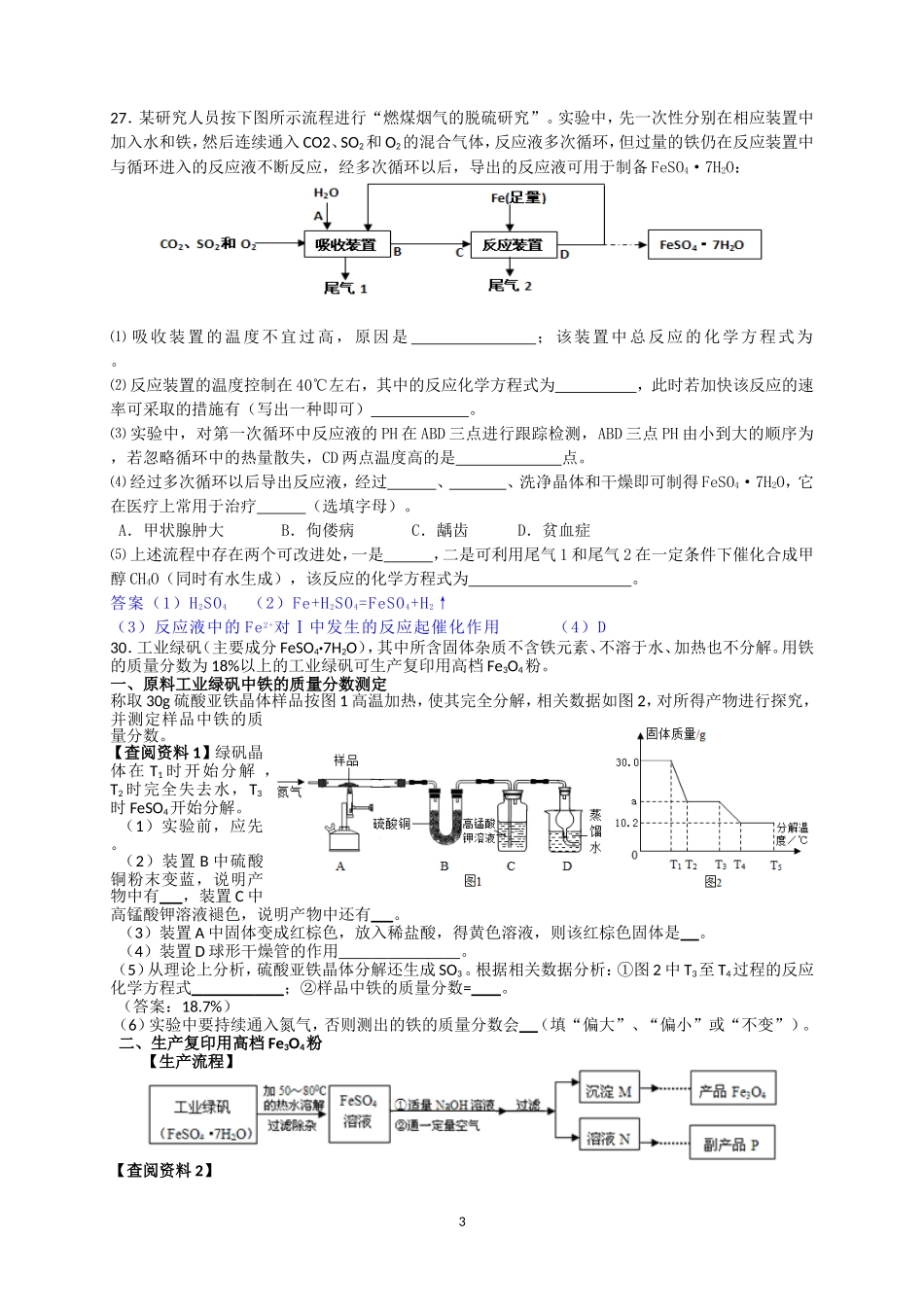
扬中市新坝中学2015年中考零距离(化学)2015.6.1215.t℃时两份质量、浓度均相等的不饱和Na2CO3溶液,分别加入Na2CO3粉末和Na2CO3•10H2O,溶液都转化为饱和状态,有关变化情况如右图示。(已知:从Na2CO3溶液中析出的晶体是Na2CO3•10H2O,Na2CO3•10H2O中Na2CO3的质量分数为37%)。下列说法错误的是()A.曲线①②分别代表加入Na2CO3粉末和Na2CO3•10H2OB.纵坐标M<37%C.t℃时Na2CO3的溶解度为30.0gD.若该不饱和溶液中加入Na2CO3粉末6.0g,则析出0.8g晶体15.将一定量xFeSO4•y(NH4)2SO4•6H2O晶体加入到过NaOH溶液中,加热生成NH30.85g(假如生成NH3的全部逸出),过滤、洗涤、灼烧,得Fe2O3固体2.0g.则x,y的关系正确的是()A.x:y=1:1B.x:y=1:2C.x:y=1:4D.x:y=2:1【解析】据质量守恒定律可以知道,晶体中的氮元素和氨气中的氮元素的质量相等,而晶体中的铁元素的质量和生成的氧化铁中的铁元素的质量相等,即:56x:(14×2)y=(2.0g××100%):(0.85g××100%)解得:x:y=1:1故选A.15.将5.6g铝铁混合金属粉末中加入100g某溶量分数的稀硫酸,恰好完全反应,则该稀硫酸的溶质质量分数可能是()A.5%B.9.8.0%C.15.0%D.30.5%【解析】铝铁混合物和稀硫酸恰好完全反应,即为铝、铁分别和稀硫酸反应,可采用假设极限法,求得区间。根据反应可求:全为铁时:得ω=9.8%全为铝时:得ω=30.5%则铝铁混合物时为:9.8%﹤ω﹤30.5%故选C.15.向含H2SO4和CuSO4的混合溶液中加入m克铁粉(过量),充分反应后过滤、洗涤、烘干(隔绝空气)得固体质量仍为m克.则原混合溶液中H2SO4和CuSO4的质量比为()A.49:80B.7:80C.1:1D.任意比【解析】题中铁与硫酸反应固体质量减轻(记为M1),铁与硫酸铜反应,固体质量增重(M2),因为固体质量m不变。所以M1=M2,如设H2SO4质量为x,CuSO4的质量为y.M1=56x/98;M2=8y/160;56x/98=8y/160;x:y=7:80.故选B19.将10克锌(过量)投入装有AgNO3、Cu(NO3)2混合溶液的烧杯中,对烧杯中的固体和溶液的质量进行测定,绘制出关系曲线如下,下列叙述正确的是()A.Y表示固体的质量B.C点时,烧杯中固体是Ag、CuC.A点时,烧杯中溶液的溶质是AgNO3、Cu(NO3)2D.取BC段溶液,滴加氯化钠溶液,生成白色沉淀19:向一定量硫酸和硫酸铜的混合溶液中,逐滴加入一定质量分数的氢氧化钠溶液,直至过量。某同学依据实验事实绘制了如图所示的曲线。下列说法不正确的是()A.a至b段对应溶液的pH逐渐增大B.b点对应溶液中的溶质为硫酸钠C.c点对应溶液中的溶质种类最少D.a至d段硫酸钠的质量逐渐增大120.亚氯酸钠是地震灾区常使用的消毒剂之一。以下是用过氧化氢法生产亚氯酸钠的工艺流程图:下列说法正确的是()A.亚氯酸钠(NaClO2)中Cl元素的化合价是+3价B.ClO2发生器里发生的反应:2NaClO3+SO2=2ClO2+Na2SO4属于复分解反应C.滤液中仅含有的溶质是NaClO2D.该流程中有三种元素的化合价发生了改变25.氯水(氯气溶于水制成的溶液)有漂白性,SO2也有漂白性,如果将二者混合使用,漂白效果减弱,原因是反应生成了两种强酸。写出该反应的化学方程式::。25.我国卫生部明确规定:要逐步用二氧化氯(ClO2)代替氯气进行饮用水的消毒。ClO2不稳定,可与NaOH溶液和H2O2反应,转化为比较稳定的亚氯酸钠(NaClO2)溶液和一种能使带火星木条复燃的气体。补充完成该反应的化学方程式:□ClO2+□NaOH+□H2O2=□NaClO2+□+□。25.已知一定温度下硫酸铜受热分解生成氧化铜、三氧化硫、二氧化硫和氧气;SO2、SO3都能被氢氧化钠溶液吸收。现进行如下实验:①加热10g硫酸铜粉末至完全分解,②将生成的气体通入足量的浓的氢氧化钠溶液。反应结束后称量①中固体质量变为5g,②中溶液增加了4.5g。该实验中硫酸铜分解的化学方程式是。27.在FeCl3溶液蚀刻铜箔制造电路板的工艺中,废液(主要含有FeCl2和CuCl2)处理和资源回收的工业流程如下:试回答下列问题:(1)过程①中Cu和FeCl3反应的化学方程式:;过程②加入铁屑后发生的置换反应的化学方程式:;(2)步骤②得到滤渣的成分是;步骤③的操作是过滤、、干燥等。(3)Fe(OH)2与O2和H2O反应生成色Fe(OH)3。...