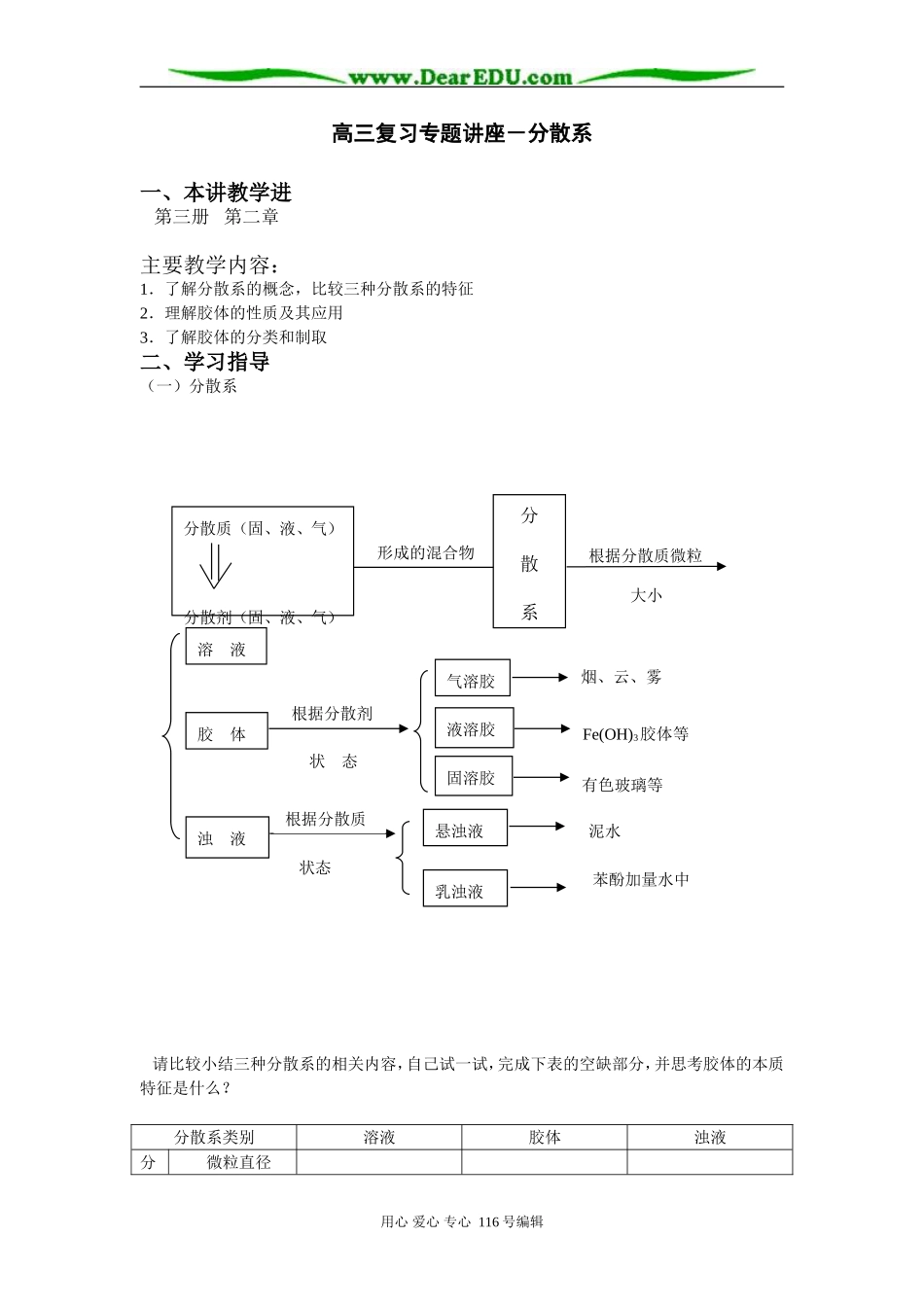
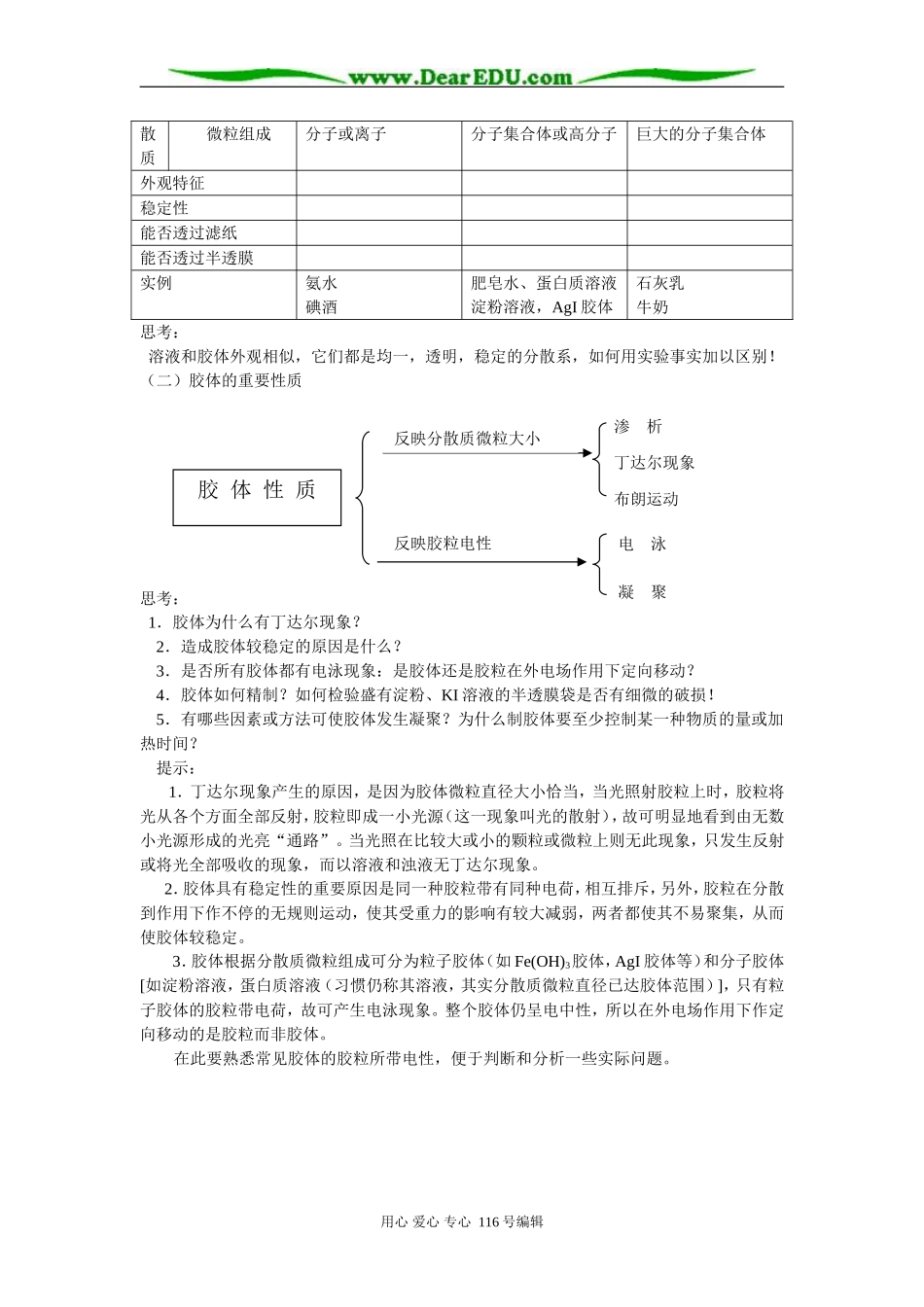
高三复习专题讲座-分散系一、本讲教学进第三册第二章主要教学内容:1.了解分散系的概念,比较三种分散系的特征2.理解胶体的性质及其应用3.了解胶体的分类和制取二、学习指导(一)分散系请比较小结三种分散系的相关内容,自己试一试,完成下表的空缺部分,并思考胶体的本质特征是什么?分散系类别溶液胶体浊液分微粒直径用心爱心专心116号编辑形成的混合物分散质(固、液、气)分散剂(固、液、气)分散系根据分散质微粒大小溶液胶体浊液根据分散剂状态气溶胶液溶胶固溶胶烟、云、雾Fe(OH)3胶体等有色玻璃等悬浊液乳浊液泥水苯酚加量水中根据分散质状态散质微粒组成分子或离子分子集合体或高分子巨大的分子集合体外观特征稳定性能否透过滤纸能否透过半透膜实例氨水碘酒肥皂水、蛋白质溶液淀粉溶液,AgI胶体石灰乳牛奶思考:溶液和胶体外观相似,它们都是均一,透明,稳定的分散系,如何用实验事实加以区别!(二)胶体的重要性质思考:1.胶体为什么有丁达尔现象?2.造成胶体较稳定的原因是什么?3.是否所有胶体都有电泳现象:是胶体还是胶粒在外电场作用下定向移动?4.胶体如何精制?如何检验盛有淀粉、KI溶液的半透膜袋是否有细微的破损!5.有哪些因素或方法可使胶体发生凝聚?为什么制胶体要至少控制某一种物质的量或加热时间?提示:1.丁达尔现象产生的原因,是因为胶体微粒直径大小恰当,当光照射胶粒上时,胶粒将光从各个方面全部反射,胶粒即成一小光源(这一现象叫光的散射),故可明显地看到由无数小光源形成的光亮“通路”。当光照在比较大或小的颗粒或微粒上则无此现象,只发生反射或将光全部吸收的现象,而以溶液和浊液无丁达尔现象。2.胶体具有稳定性的重要原因是同一种胶粒带有同种电荷,相互排斥,另外,胶粒在分散到作用下作不停的无规则运动,使其受重力的影响有较大减弱,两者都使其不易聚集,从而使胶体较稳定。3.胶体根据分散质微粒组成可分为粒子胶体(如Fe(OH)3胶体,AgI胶体等)和分子胶体[如淀粉溶液,蛋白质溶液(习惯仍称其溶液,其实分散质微粒直径已达胶体范围)],只有粒子胶体的胶粒带电荷,故可产生电泳现象。整个胶体仍呈电中性,所以在外电场作用下作定向移动的是胶粒而非胶体。在此要熟悉常见胶体的胶粒所带电性,便于判断和分析一些实际问题。用心爱心专心116号编辑胶体性质反映分散质微粒大小反映胶粒电性渗析丁达尔现象布朗运动电泳凝聚带正电的胶粒胶体金属氢氧化物如Al(OH)3、Fe(OH)3胶体金属氧化物带负电的胶粒胶体非金属氧化物金属硫化物硅酸胶体土壤胶体特殊:AgI胶粒随着AgNO3和KI相对量不同,而可带正电或负电。若KI过量,则AgI胶粒吸附较多I-而带负电;若AgNO3过量,则因吸附较多Ag+而带正电。4.应用渗析洁皿用流动水来精制胶体,若要检验半透膜袋有无损坏,则应取悬放过此袋样品的烧杯中少量溶液,向其中加入大量I2溶液,若变蓝,则可说明已损坏,淀粉胶体已透过半透膜进入水中。思考再进一步:能否用溴水代替碘水?何故?5.凝聚方法(1)加入电解质①原因:电解质电离出的阴、阳离子与胶粒所带的电荷发生电性中和,设胶粒向斥力下降,胶粒相互结合,导致颗粒直径>10-7m,从而沉降。②能力:离子电荷数,离子半径,凝聚能力阳离子使带负电荷胶粒的胶体凝聚的能力顺序为:Al3+>Fe3+>H+>Mg2+>Na+阴离子使带正电荷胶粒的胶体凝聚的能力顺序为:SO42->NO3->Cl-思考①淀粉胶体加入少量电解质能否使其凝聚?(否!)有无电泳现象?(无!)思考②Fe(OH)3胶体中分别逐渐加入HCl溶液、MgCl2溶液,现象有何异同?为什么?(加入过量盐酸,使胶体凝聚成Fe(OH)3沉淀后又发生中和反应而溶解成FeCl3溶液,而MgCl2能使胶体凝聚而不能溶解)(2)加入带异性电荷胶粒的胶体思考:将Fe(OH)3胶体和硅酸胶体混合有何现象?什么原因?(3)加热、光照或射线等如蛋白质溶液加热,较长时间光照都可使其凝聚甚至变性。你知道豆腐的生产过程吗?为什么常常加入石膏?(三)胶体的知识应用胶体的知识在生活、生产和科研等方面有着重要用途,如常见的有①盐卤点豆腐②肥皂的制取分离③明矾、Fe(SO)3溶液净水用心爱心专心116号编辑④FeCl3溶...