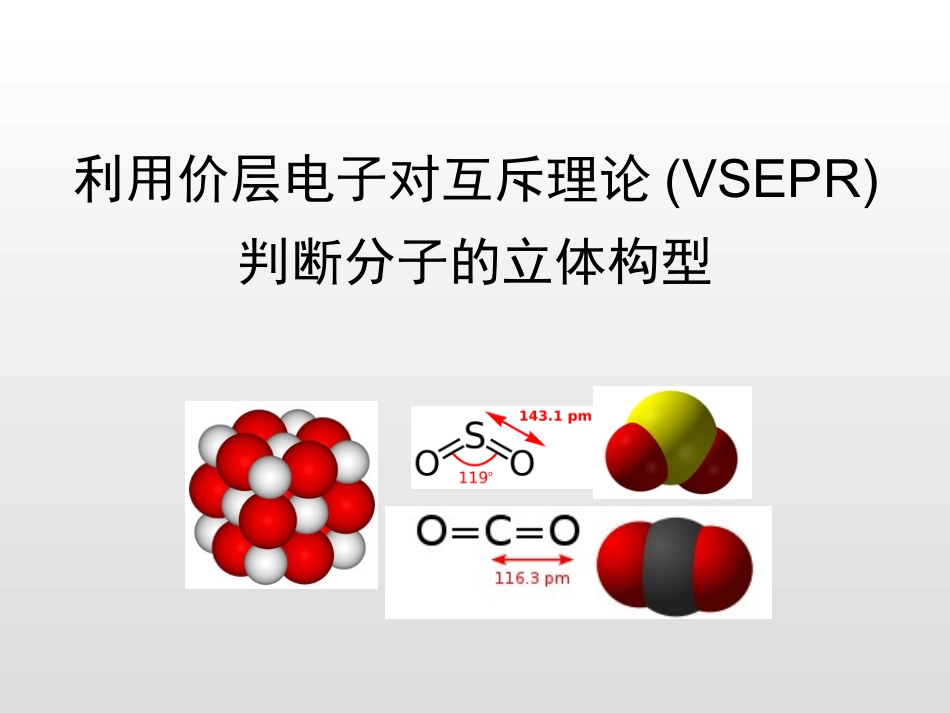
利用价层电子对互斥理论(VSEPR)判断分子的立体构型序言•1体积水可以溶解1体积CO2,1体积水可以溶解40体积SO2•AB2型分子:CO2和SO2•CO2的沸点为-78.5℃,SO2的沸点为-10℃序言VSEPRTheory•VSEPR=ValenceShellElectronPairRepulsion,意为价层电子对互斥。吉莱斯皮RonaldJ.Gillespie英裔加拿大化学家McMasterUniversity•1940年代,美国化学家Sidgwick和Powell提出VSEPR理论,用于解释分子形状。•VSEPR的核心思想是:原子周围的电子对(包括成键电子对BP和孤对电子LP)相互排斥,采取最大远离的空间几何排布。•1960年代,美国化学家Nyholm和Gillespie发展了VSEPR理论,使之成为今天通用的形式。价层电子对数的计算01价层电子对数=σ键电子对数+中心原子上的孤电子对数⑴σ键电子对数=σ键个数=与中心原子结合的原子数⑵中心原子上的孤电子对数=(a-xb)/2=(a-xb-电荷数)/2a:中心原子价电子数;x:与中心原子结合的原子数;b:与中心原子结合的原子最多能接受的电子数。(H=1,其他原子=8-最外层电子数)分子或离子σ键电子对数中心原子上孤电子对数价层电子对数VSEPR模型及名称立体构型及名称CH4NH4+NH3H2OBF3CO32-SO2CO2探究活动-----计算价层电子对数,并预测其分子的立体构型分子或离子σ键电子对数中心原子上孤电子对数价层电子对数VSEPR模型及名称立体构型及名称CH44½(4-4×1)=04NH4+4½(5-4×1-1)=04NH33½(5-3×1)=14H2O2½(6-2×1)=24BF33½(3-3×1)=03CO32-3½(4-3×2+2)=03SO22½(6-2×2)=13CO22½(4-2×1)=02探究活动-----计算价层电子对数,并预测其分子的立体构型02学生活动:搭建气球模型•分组实验利用2~4个小气球拼接出ABn(n=2~4)模型,体会在ABn型分子中,原子处于“最大间距”位置。分子或离子σ键电子对数中心原子上孤电子对数价层电子对数VSEPR模型及名称立体构型及名称CH44½(4-4×1)=04NH4+4½(5-4×1-1)=04NH33½(5-3×1)=14H2O2½(6-2×1)=24BF33½(3-3×1)=03CO32-3½(4-3×2+2)=03SO22½(6-2×2)=13CO22½(4-2×1)=02探究活动-----计算价层电子对数,并预测其分子的立体构型正四面体形正四面体形四面体形四面体形平面三角形平面三角形平面三角形直线形分子或离子σ键电子对数中心原子上孤电子对数价层电子对数VSEPR模型及名称立体构型及名称CH44½(4-4×1)=04NH33½(5-3×1)=14H2O2½(6-2×1)=24探究活动-----计算价层电子对数,并预测其分子的立体构型正四面体形四面体形四面体形正四面体形NHHH三角锥形V形分子或离子σ键电子对数中心原子上孤电子对数价层电子对数VSEPR模型及名称立体构型及名称BF33½(3-3×1)=03CO22½(4-2×2)=02SO22½(6-2×2)=13探究活动-----计算价层电子对数,并预测其分子的立体构型平面三角形直线形平面三角形平面三角形直线形V形分子或离子σ键电子对数中心原子上孤电子对数价层电子对数VSEPR模型及名称立体构型及名称CH44½(4-4×1)=04正四面体形NH4+4½(5-4×1-1)=04正四面体形NH33½(5-3×1)=14四面体形H2O2½(6-2×1)=14四面体形BF33½(3-3×1)=03平面三角形CO32-3½(4-3×2+2)=03平面三角形SO22½(6-2×2)=13平面三角形CO22½(4-2×1)=02直线形探究活动-----计算价层电子对数,并预测其分子的立体构型正四面体形正四面体形三角锥形V形平面三角形平面三角形V形直线形03学生活动三:分组讨论孤对电子对分子结构的影响•孤对电子对相邻电子对的斥力大于成键电子对。因此,孤对电子会压缩相邻的键角。•LP-LP>>LP-BP>BP-BP•三键-三键>三键-双键>双键-双键>双键-单键>单键-单键•LP-LP必须在夹角大于90°的构型中。分子或离子σ键电子对数中心原子上孤电子对数价层电子对数VSEPR模型及名称立体构型及名称BeCl2SCl2PF3SO32-作业03Thankyouforyourattention!