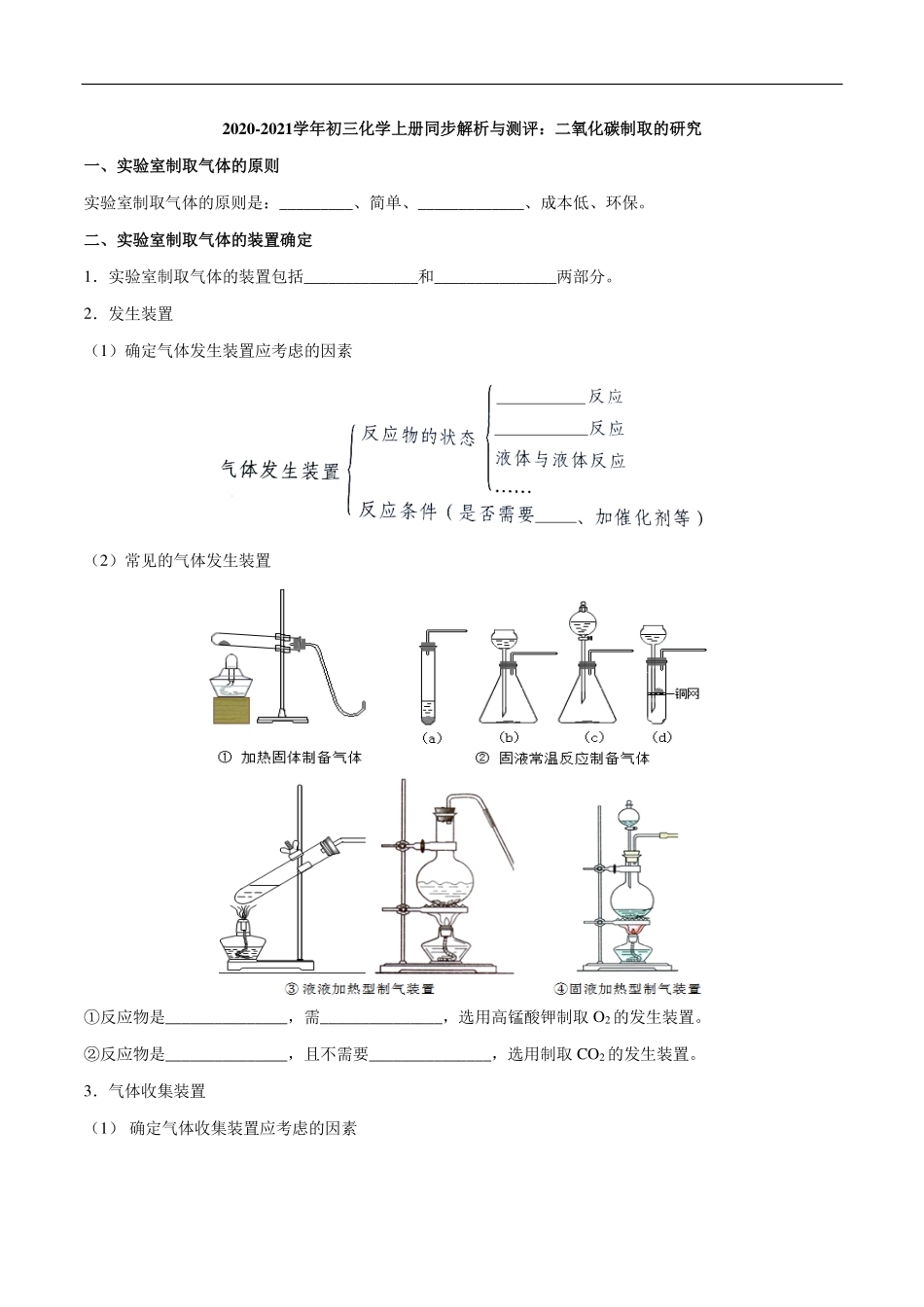
2020-2021学年初三化学上册同步解析与测评:二氧化碳制取的研究一、实验室制取气体的原则实验室制取气体的原则是:_________、简单、_____________、成本低、环保。二、实验室制取气体的装置确定1.实验室制取气体的装置包括______________和_______________两部分。2.发生装置(1)确定气体发生装置应考虑的因素(2)常见的气体发生装置①反应物是_______________,需_______________,选用高锰酸钾制取O2的发生装置。②反应物是_______________,且不需要_______________,选用制取CO2的发生装置。3.气体收集装置(1)确定气体收集装置应考虑的因素(2)常见的气体收集装置①难溶于水且不与水反应的用_______________收集。②密度比空气大(或相对分子质量>29)且不与空气反应的用向____________排空气法。③密度比空气小(或相对分子质量<29)且不与空气反应的用向____________排空气法。三、实验室制取二氧化碳1.药品________(或大理石)与________。2.原理用石灰石和稀盐酸反应:CaCO3+2HCl__________________________________________H2O+CO2↑总反应为:CaCO3+2HCl___________________________3.装置注意:长颈漏斗下端必须伸入_____________________。伸入集气瓶中的导管应伸至__________________。4.气体收集方法二氧化碳密度比空气大,不与空气中成分发生反应,能溶于水,故采用_______________收集。5.检验方法将制得的气体通入澄清的石灰水,若澄清石灰水_______________,则证明是二氧化碳。6.验满方法将燃着的木条放在集气瓶_______________,木条熄灭,证明已集满二氧化碳气体。四、实验室制取气体的一般思路和方法1.选择适当的反应,包括反应物和___________。2.选择合适的实验装置。3.验证所制得的气体。一、安全便于收集二、1.发生装置收集装置2.(1)固体与固体固体与液体加热(2)①固体加热②固体与液体加热3.(1)向上排空气法向下排空气法不与水反应(2)①排水法②上③下三、1.石灰石稀盐酸2.CaCl2+H2CO3H2CO3CaCl2+H2O+CO2↑3.液面以下集气瓶底部4.向上排空气法5.变浑浊6.瓶口四、1.反应条件一、制取二氧化碳药品选择的探究1.液体不能用稀硫酸,因为稀硫酸与碳酸钙反应会生成微溶于水的硫酸钙,硫酸钙覆盖在大理石的表面,使反应逐渐停止。2.也不能用浓盐酸,因为浓盐酸易挥发,挥发出氯化氢气体,而使制得的二氧化碳气体不纯。3.固体不能用碳酸钠代替大理石,因为碳酸钠与盐酸反应太剧烈,使生成的气体不易收集,同时,碳酸钠相对于大理石来说价格较高,不经济。4.用石灰石和稀盐酸制得的二氧化碳不纯,含有杂质氯化氢和水蒸气,若实验要求制取纯净干燥的二氧化碳,需依次通过盛有饱和碳酸氢钠、浓硫酸的洗气瓶除杂。结论:在实验室里制取二氧化碳,最佳药品是用大理石或石灰石和稀盐酸反应,二者反应速率适中、药品价格廉价易得,制得的气体比较纯净。实验室制备并收集二氧化碳,按下表进行实验,取等质量的同种大理石加入足量酸中(杂质不与酸反应),产生二氧化碳气体随时间变化曲线如图所示,下列说法错误的是()i实验编号药品Ⅰ块状大理石、10%、H2SO4溶液Ⅱ块状大理石、7%、HCl溶液Ⅲ大理石粉末、7%、HCl溶液A.实验Ⅲ对应的如图变化曲线为甲B.实验Ⅱ和Ⅲ对比,说明影响反应速率的因素是固体的颗粒大小C.实验Ⅰ和Ⅱ对比,说明影响反应速率的因素是酸的浓度D.实验Ⅱ和Ⅲ完全反应后,产生二氧化碳的质量是相等的【解析】A.大理石的主要成分是碳酸钙,碳酸钙与盐酸反应生成氯化钙、水和二氧化碳,且大理石是粉末状的,反应的速率最快,所以实验Ⅲ对应的如图变化曲线为甲,选项说法正确;B.Ⅱ和Ⅲ中选择酸都是7%HCl溶液,Ⅱ中是块状大理石,Ⅲ中是大理石粉末,实验Ⅱ和Ⅲ对比,说明影响反应速率的因素是固体的颗粒大小,选项说法正确;C.实验Ⅰ和Ⅱ中所用酸的种类不同,没有可比性,选项说法错误;D.由图象可知,实验Ⅱ和Ⅲ完全反应后,产生二氧化碳的质量是相等的,选项说法正确。【答案】C二、实验室制取气体的思路1.方法的选择确定实验室制取气体的化学反应时,应考虑以下几个方面的因素:(1)原料要容易获...