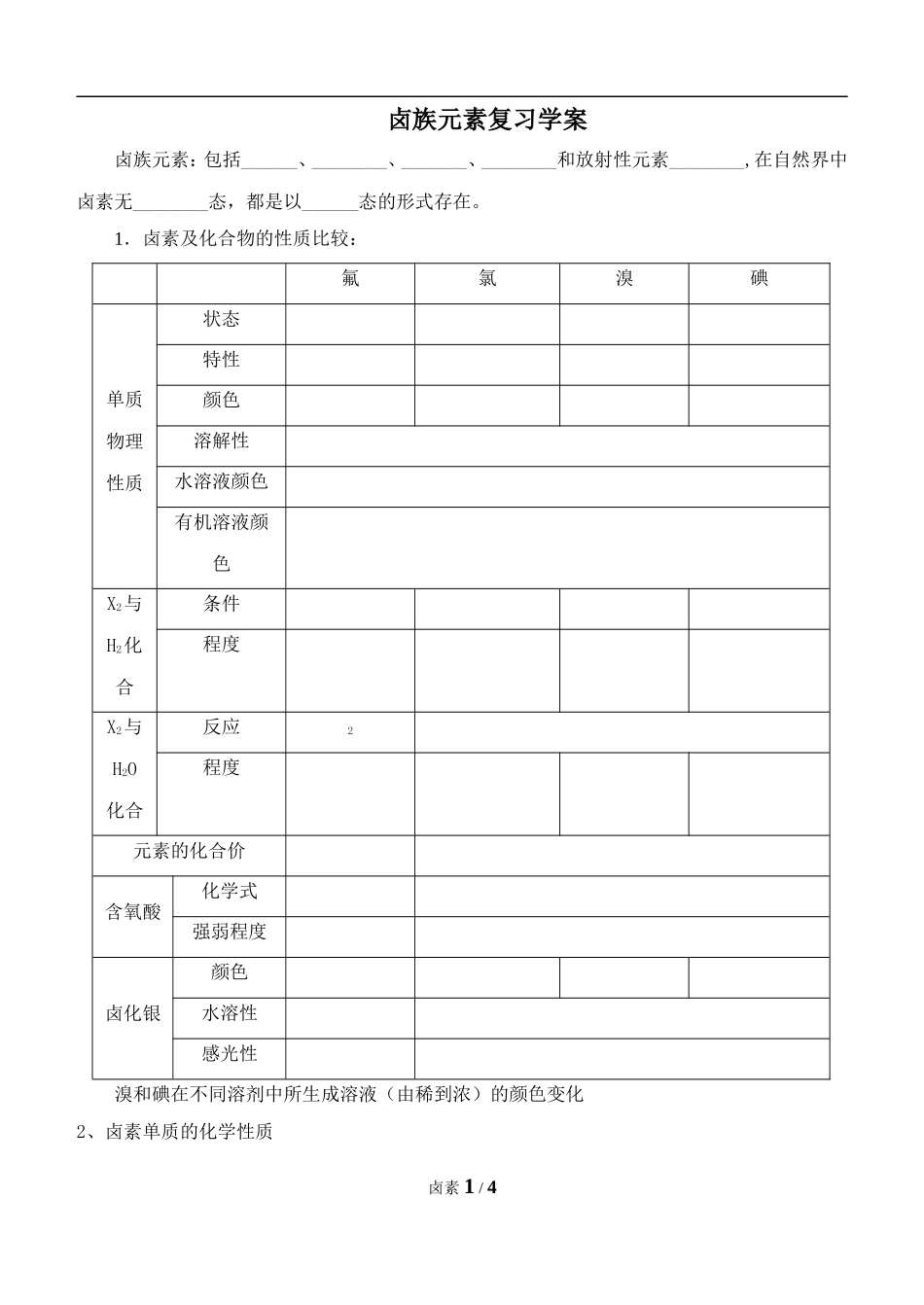
卤族元素复习学案卤族元素:包括______、________、_______、________和放射性元素________,在自然界中卤素无________态,都是以______态的形式存在。1.卤素及化合物的性质比较:氟氯溴碘单质物理性质状态特性颜色溶解性水溶液颜色有机溶液颜色X2与H2化合条件程度X2与H2O化合反应2程度元素的化合价含氧酸化学式强弱程度卤化银颜色水溶性感光性溴和碘在不同溶剂中所生成溶液(由稀到浓)的颜色变化2、卤素单质的化学性质卤素1/4⑴卤素原子结构和元素性质的相似性和递变性核电核数__F__CI___Br___I原子结构的相似性卤素原子最外层上均有个电子化学性质的相似性均为活泼非金属,最低负化合价:,最高正价:(除外);原子结构的递变性从F→I,原子核外电子层数依次,原子半径依次。元素性质递变性随着原子序数的递增,获得电子的能力逐渐,非金属性逐渐。注:a.单质的氧化性:____>____>____>____b.HX稳定性:____>____>____>____c..X-的还原性:____<____<____<____d..HX水溶液的酸性:____<____<____<____(HF为酸)⑵卤素单质与金属的反应(生成金属卤化物)与铁反应:CI2、Br2生成______________,而I2生成________。⑶能与H2化合(生成卤化氢气体)通式:______________________。卤化氢为色气体,极易溶于水,在潮湿空气中形成____。水溶液都是挥发性的无氧酸。⑷与水、碱溶液反应(除氟气外均可发生卤素的自身氧化还原反应)①F2+H2O==______________②X2与水反应的化学方程式:(X为Cl2、Br2、I2);X2与NaOH反应的化学方程式:(X为Cl2、Br2、I2)。⑸卤素间的置换反应及X-离子的检验:①Cl2+2Br-=___________(加入CCI4并振荡后,液体分层,上层为___色的____层,下层为___色的______________层)。Cl2+2I-=I2+2Cl-Br2+2I-=I2+2Br-(加入CCI4并振荡后,液体分层,上层为___色的____层,下层为___色的______________层)。卤素2/4结论:氧化性:Cl2____Br2___I2;还原性:I-___Br-___Cl-②X-离子的检验Cl-________色沉淀Br-+AgNO3+HNO3________色沉淀I-_______色沉淀⑹与其它还原性微粒反应X2()X—3.卤素元素的有关特性:(1)F2遇水发生置换反应,生成____并放出____。只有价,没有价。且能与稀有气体化合。(2)溴是唯一的液态非金属,易挥发,少量的液溴保存要用水封。(3)碘易升华,遇淀粉显蓝色;碘的氧化性较弱,它与变价金属反应时生成低价化合物。(4)卤化氢均易溶于水,在空气中形成白雾,其中只有HF剧毒,但HX都是大气污染物,水溶液均呈酸性,唯有是弱酸,从___到______,酸性逐渐增强(5)能腐蚀玻璃__________________,实验室中常用塑料或铅制容器保存。HF由于形成分子间氢键相互缔合,沸点反常的___。⑹AgX中只有AgF溶于水,且不具有感光性;其余AgX均具有感光性,AgBr做感光材料,AgI做人工降雨材料。⑺CaF2中只有CaF2难溶,CaCI2可做干燥剂,NaX中只有NaF有毒,可用作农药⑻为防治碘缺乏病,最为方便、有效的方法就是食用加碘盐,通常加入______。⑼HCIO、HCIO2、HCIO3、HCIO4酸性逐渐增强,氧化性逐渐减弱。4、HX的制备:实验室制取原理---用难挥发性酸制取易挥发性酸HF:CaF2+H2SO4(浓)CaSO4+2HF↑(用铅皿)HCl:①NaBr+H3PO4(浓)NaH2PO4+HBr↑②NaBr+H3PO4(浓)NaH2PO4+HBr↑HBr:NaBr+H3PO4(浓)NaH2PO4+HBr↑;卤素3/4微热微热HI:KI+H3PO4(浓)NaH2PO4+HI↑思考:制取HBr、HI能否用浓硫酸?为什么?1.海水中提取溴(1)富集:蒸发浓缩,制取海盐所得苦卤中,溴离子浓度可达6g/L。(2)氧化:通入氯气,使溴离子氧化成单质。(3)提取粗溴:向苦卤中吹人热空气,使溴挥发,冷凝后即得粗溴。(4)粗溴提纯:Br2→Br-→Br2①通入SO2:Br2+SO2+2H2O→2HBr+H2SO4;②再次用Cl2氧化,热空气或水蒸气吹出,即可得高纯液溴。其流程图如下:2.海带提碘(1)从海带中得到I-:将海带晒干,灼烧成灰,用水溶解浸泡,使I-进入水中,过滤,除灰渣。(2)氧化:通人氯气,使I-转化为I2。(3)提取碘:用四氯化碳萃取,得到碘的四氯化碳溶液,再蒸馏除去四氯化碳得粗碘,利用升华法得到纯净的碘单质。其流程图如下:卤素4/4Cl2SO2