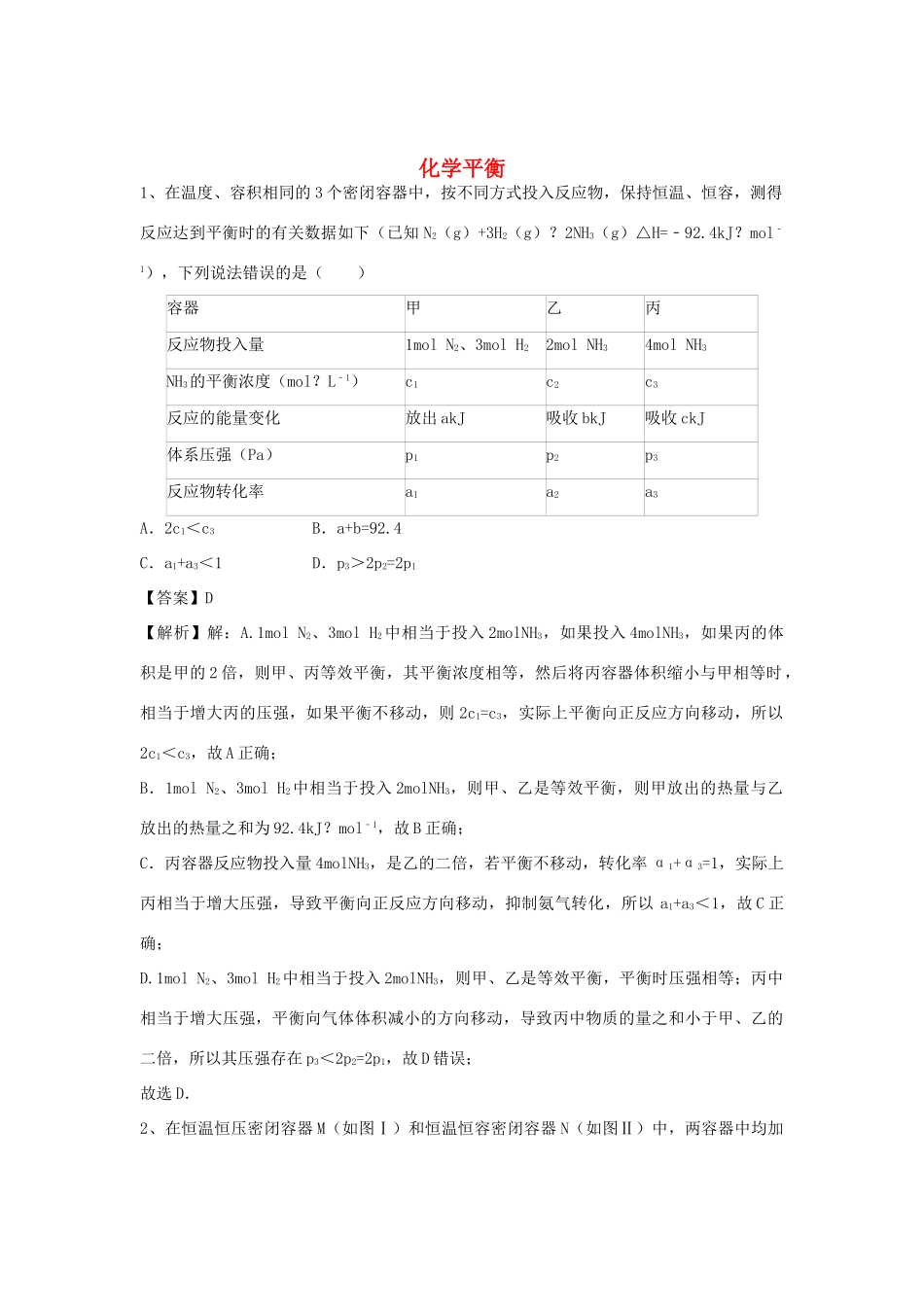
化学平衡1、在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下(已知N2(g)+3H2(g)?2NH3(g)△H=﹣92.4kJ?mol﹣1),下列说法错误的是()容器甲乙丙反应物投入量1molN2、3molH22molNH34molNH3NH3的平衡浓度(mol?L﹣1)c1c2c3反应的能量变化放出akJ吸收bkJ吸收ckJ体系压强(Pa)p1p2p3反应物转化率a1a2a3A.2c1<c3B.a+b=92.4C.a1+a3<1D.p3>2p2=2p1【答案】D【解析】解:A.1molN2、3molH2中相当于投入2molNH3,如果投入4molNH3,如果丙的体积是甲的2倍,则甲、丙等效平衡,其平衡浓度相等,然后将丙容器体积缩小与甲相等时,相当于增大丙的压强,如果平衡不移动,则2c1=c3,实际上平衡向正反应方向移动,所以2c1<c3,故A正确;B.1molN2、3molH2中相当于投入2molNH3,则甲、乙是等效平衡,则甲放出的热量与乙放出的热量之和为92.4kJ?mol﹣1,故B正确;C.丙容器反应物投入量4molNH3,是乙的二倍,若平衡不移动,转化率α1+α3=1,实际上丙相当于增大压强,导致平衡向正反应方向移动,抑制氨气转化,所以a1+a3<1,故C正确;D.1molN2、3molH2中相当于投入2molNH3,则甲、乙是等效平衡,平衡时压强相等;丙中相当于增大压强,平衡向气体体积减小的方向移动,导致丙中物质的量之和小于甲、乙的二倍,所以其压强存在p3<2p2=2p1,故D错误;故选D.2、在恒温恒压密闭容器M(如图Ⅰ)和恒温恒容密闭容器N(如图Ⅱ)中,两容器中均加入amolA和amolB,起始时两容器体积均为VL,发生如下反应并达到化学平衡状态:2A(?)+B(?)xC(g)△H<0,平衡时M中A、B、C的物质的量之比为1:3:4.下列判断不正确的是()A.x=2B.若N中气体的密度如图Ⅲ所示,则A、B只有一种是气态C.A为气体,B为非气体,则平衡时M、N中C的物质的量相等D.若A、B均为气体,平衡时M中A的转化率小于N中A的转化率【答案】D【解析】A.2A(?)+B(?)xC(g)△H<0起始量(mol)aa0变化量(mol)2YYxY平衡量(mol)a﹣2Ya﹣YxY根据题意可知(a﹣2Y):(a﹣Y):xY=1:3:4,解得x=2,a=2.5y,故A正确;B.由图三可知随着反应的进行,气体密度增大,生成物C是气体,N是体积不变的容器,根据ρ=,V不变,若要ρ增大,则气体混合物质量m应该增大,因此反应物中至少有一种不是气体,又因为初始状态气体密度不是0,则A、B一定有一种是气体,所以A、B只有一种是气体,故B正确;C.当B为非气体时,反应为气体体积不变的可逆反应,这时M容器与N容器内反应达到平衡等效,由于起始加入的反应物的量相等,故平衡时生成物的量相等,故C正确;D.若A、B均为气体,这时正反应为气体体积减小的反应,则M容器相当于N容器中的反应达到平衡后再加压,平衡要向正反应方向移动,A的转化率将增大,即M中A的转化率则大于N中A的转化率,故D错误,故选D.3、在一定条件下将1mol的CO和水蒸气放入密闭容器中发生反应:CO(g)+H2O(g)CO2(g)+H2(g),达到平衡时测得CO2为0.6mol,再通入4mol水蒸气,达到平衡后,CO2的物质的量为()A.0.6molB.1molC.大于0.6molD.大于1mol【答案】C【解析】再通入4mol水蒸气,平衡正向移动,但一氧化碳仍然有剩余。4、某可逆反应:A(g)+3B(g)2C(g);△H<0.有甲乙两个容积为0.5L的密闭容器,向甲容器中加入1molA的和3molB在一定条件下达到平衡时放出热量为Q1kJ;在相同条件下,向乙容器中加入2molC达到平衡时吸收热量为Q2kJ;已知Q2=3Q1.下列叙述不正确的是()A.乙中C的转化率为75%B.反应达到平衡前,甲中始终有v正大于v逆,乙中始终有v正小于v逆C.在该条件下,反应2C(g)A(g)+3B(g)的平衡常数为27×1.54(mol/L)2D.乙中的热化学方程式为2C(g)A(g)+3B(g);△H=+Q2kJ/mol【答案】D【解析】解:A.甲容器中开始加入1molA的和3molB与乙容器中开始加入2molC为完全等效平衡,平衡时相同组分的物质的量相等,设甲中平衡时C为xmol,则乙中反应的C为(2﹣x)mol,由于Q2=3Q1,则(2﹣x)mol=3xmol,解得x=0.5,故乙中C的转化率为×100%=75%,故A正确;B.甲中反应正向进行建立平衡,乙中逆向进行建立平衡,故反应达...