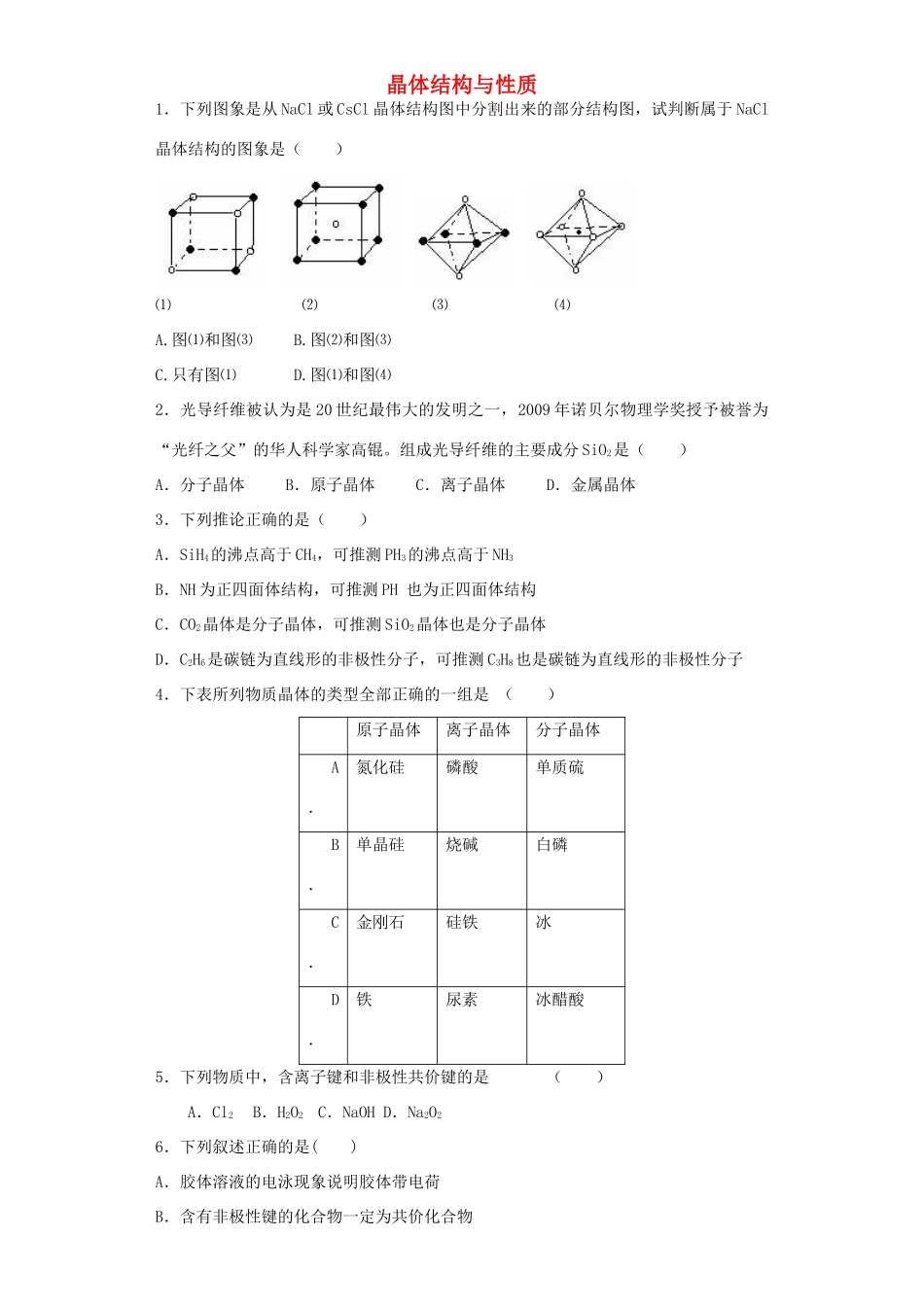
晶体结构与性质1.下列图象是从NaCl或CsCl晶体结构图中分割出来的部分结构图,试判断属于NaCl晶体结构的图象是()⑴⑵⑶⑷A.图⑴和图⑶B.图⑵和图⑶C.只有图⑴D.图⑴和图⑷2.光导纤维被认为是20世纪最伟大的发明之一,2009年诺贝尔物理学奖授予被誉为“光纤之父”的华人科学家高锟。组成光导纤维的主要成分SiO2是()A.分子晶体B.原子晶体C.离子晶体D.金属晶体3.下列推论正确的是()A.SiH4的沸点高于CH4,可推测PH3的沸点高于NH3B.NH为正四面体结构,可推测PH也为正四面体结构C.CO2晶体是分子晶体,可推测SiO2晶体也是分子晶体D.C2H6是碳链为直线形的非极性分子,可推测C3H8也是碳链为直线形的非极性分子4.下表所列物质晶体的类型全部正确的一组是()原子晶体离子晶体分子晶体A.氮化硅磷酸单质硫B.单晶硅烧碱白磷C.金刚石硅铁冰D.铁尿素冰醋酸5.下列物质中,含离子键和非极性共价键的是()A.Cl2B.H2O2C.NaOHD.Na2O26.下列叙述正确的是()A.胶体溶液的电泳现象说明胶体带电荷B.含有非极性键的化合物一定为共价化合物C.原子晶体中共价键越强其熔点越高,如晶体硅比Si02熔点高D.含有阴离子的物质必然含有阳离子.但含有阳离子的物质不一定含有阴离子7.碳化硅(SiC)俗称金刚砂,常用作砂轮及高温炉的材料,它不导电,由此可以推知碳化硅属于()A.离子晶体B.原子晶体C.分子晶体D.无法判断8.下列说法不正确的是()A.水分子间形成氢键会使水的稳定性升高B.分散质粒子的直径在1nm-100nm之间的分散系叫做胶体C.用渗析法除去鸡蛋白溶液中少量的葡萄糖杂质D.石墨晶体中,每个正六边形平均分摊到2个碳原子9.下列有关金属的说法正确的是()A.金属原子的核外电子在金属晶体中都是自由电子B.已知金属钠的晶体堆积模型是体心立方堆积,则其配位数是6C.已知金属镁的晶体堆积模型是六方最密堆积,则其配位数是12D.金属导电的实质是金属阳离子在外电场作用下的定向移动10.水的状态除了气、液和固态外,还有玻璃态。它是由液态水急速冷却到165K时形成的,玻璃态的水无固定形状,不存在晶体结构,且密度与普通液态水的密度相同,有关玻璃态水的叙述正确的是()A.水由液态变为玻璃态,体积缩小B.水由液态变为玻璃态,体积膨胀C.玻璃态是水的一种特殊状态D.玻璃态水是分子晶体11.下列物质按熔点从低到高顺序排列的是()A.O2NaNaClSiB.O2NaClNaSiC.NaO2SiNaClD.NaNaClSiO212.下列有关晶体的叙述中,错误的是A、离子晶体在熔化时,离子键被破坏,而分子晶体熔化时化学键不被破坏B、白磷晶体中,结构粒子之间通过共价键结合C、石英晶体是直接由硅原子和氧原子通过共价键所形成的空间网状结构的晶体D、构成分子晶体的结构粒子中不一定存在共价键13.以下有关金属晶体的说法不正确的是()A.金属晶体是由金属阳离子和自由电子构成的,它们都占据在晶胞的一定位置上B.六方最密堆积和面心立方最密堆积的空间利用率相同C.金属晶体在固态或熔融态均能导电D.温度升高,金属的导电性将减弱14.氯化钠是典型的离子晶体,下列有关氯化钠晶体结构的有关叙述错误的是()A.钠离子与氯离子之间通过静电吸引结合在一起B.与某个钠离子最接近的钠离子有12个C.某个钠离子周围的氯离子围成的空间结构为正八面体D.晶体中钠离子的半径比氯离子的半径小15.下列物质的熔、沸点高低顺序中,正确的是()A.金刚石>晶体硅>二氧化硅>碳化硅B.CI4>CBr4>CCl4>CH4C.MgO>O2>N2>H2OD.金刚石>生铁>纯铁>钠16.已知X、Y、Z三种元素组成的化合物是离子晶体,其晶胞如图所示,则下面表示该化合物的化学式正确的是()A.ZXY3B.ZX2Y6C.ZX4Y8D.ZX8Y1217.下列说法中正确的是()A.共价键的键能越大,分子晶体的熔点越高B.失去电子难的原子获得电子的能力一定强C.在化学反应中,某元素由化合态变为游离态,则该元素一定被还原D.电子层结构相同的不同简单离子,其半径随核电荷数增多而减小18.氮化碳结构如下图,其中β-氮化碳硬度超过金刚石晶体,成为首屈一指的超硬新材料。下列有关氮化碳的说法不正确的是()A.氮化碳属于原子晶体B.氮化碳中碳显—4价,...