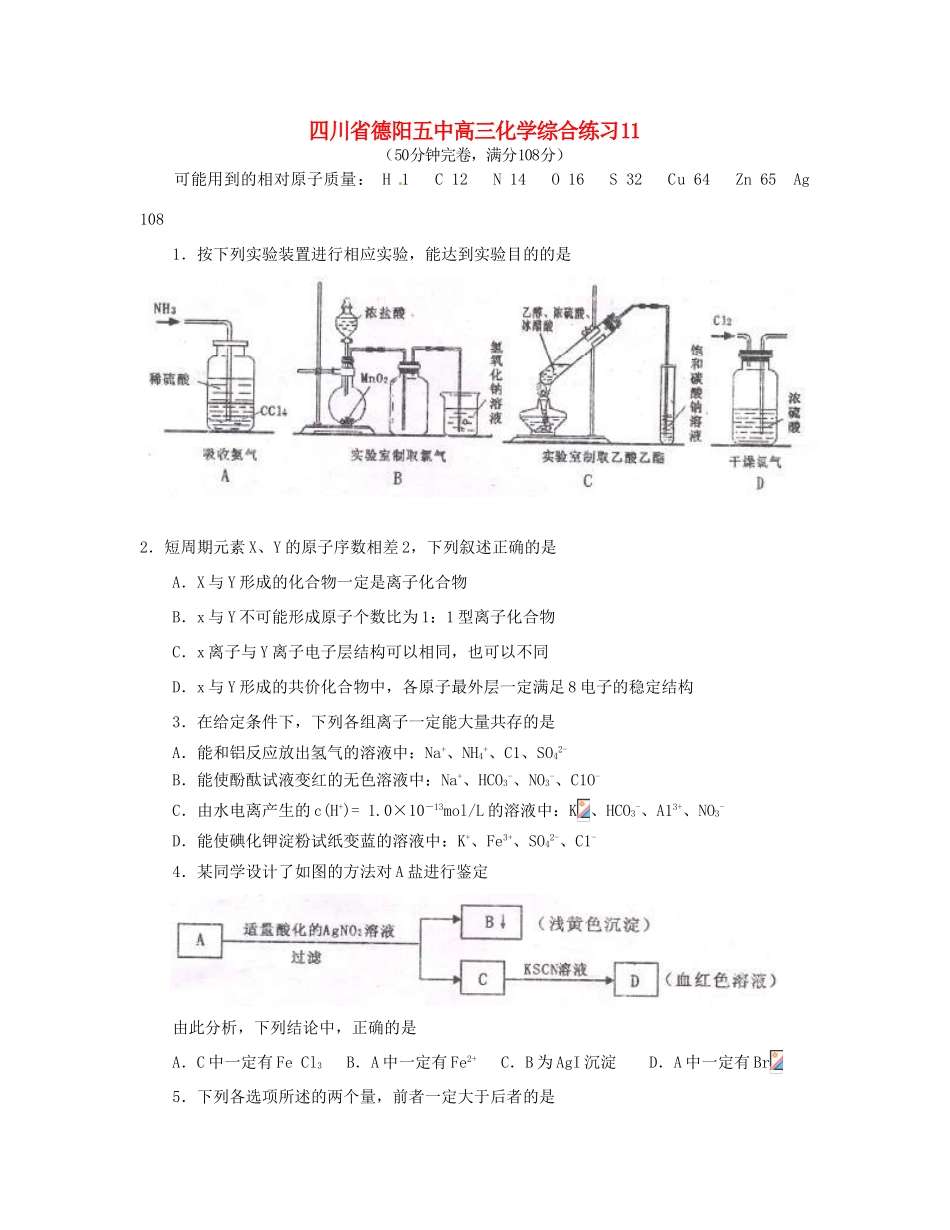
四川省德阳五中高三化学综合练习11(50分钟完卷,满分108分)可能用到的相对原子质量:H1C12N14O16S32Cu64Zn65Ag1081.按下列实验装置进行相应实验,能达到实验目的的是2.短周期元素X、Y的原子序数相差2,下列叙述正确的是A.X与Y形成的化合物一定是离子化合物B.x与Y不可能形成原子个数比为1:1型离子化合物C.x离子与Y离子电子层结构可以相同,也可以不同D.x与Y形成的共价化合物中,各原子最外层一定满足8电子的稳定结构3.在给定条件下,下列各组离子一定能大量共存的是A.能和铝反应放出氢气的溶液中:Na+、NH4+、C1、SO42-B.能使酚酞试液变红的无色溶液中:Na+、HCO3-、NO3-、C1O-C.由水电离产生的c(H+)=1.0×10-13mol/L的溶液中:K、HCO3-、A13+、NO3-D.能使碘化钾淀粉试纸变蓝的溶液中:K+、Fe3+、SO42-、C1-4.某同学设计了如图的方法对A盐进行鉴定由此分析,下列结论中,正确的是A.C中一定有FeCl3B.A中一定有Fe2+C.B为AgI沉淀D.A中一定有Br5.下列各选项所述的两个量,前者一定大于后者的是①纯水在25℃和80℃时的pH;②HF和HBr的沸点;③同温下分别在100g水中最多能溶解的无水CuSO4和CuSO4·5H2O的质量;④25℃时,等体积的pH都等于4的盐酸和AlCl3溶液中,已电离的水分子数;⑤NH3和SiH4的稳定性;⑥H-和H+离子半径;⑦金刚石晶体和石墨晶体中,每个最小碳环的所含的实际碳原子数。A.①②⑤⑥B.②④⑤⑦C.②③④⑥D.①②⑥⑦6.某溶液含有NaCl和H2SO4两种溶质,它们的物质的量之比为2:1。用石墨作电极电解该混合溶液时,根据电极产物,可明显地分为二个阶段。下列叙述中错误的是A.阴极始终只析出H2B.阳极先析出Cl2,后析出O2C.电解的最后阶段是电解水D.溶液的pH不断增大,最后pH大于77.在容积恒定的密闭容器中充入2molA和1molB,发生反应2A(g)+B(g)xC(g)达到平衡后,C的体积分数为a%;若维持容器的容积和温度不变,按起始物质的量A为0.6mol、B为0.3mol、C为1.4mol充入容器中,达到平衡后,C的体积分数仍为a%,则x的值是A.可能为2,也可能为3B.只能为2C.只能为3D.无法确定8.将一定质量的锌与10mL18.5mol·L-1浓硫酸充分反应,锌完金溶解,同对生成标准状况下的气体3.36L。将反应后的溶液稀释至100mL,测得溶液中c(H+)=0.1mol·L-1,则投入的锌的质量是A.6.5gB.9.75gC.13gD.16.25g9.(本题14分)合成氨工业对我国实现农业现代化起着很重要的作用,工业合成氨的原理是:生产流程如图1所示。回答下列问题:(1)①图1中X的化学式为______________;②条件选定的主要原因是(选填字母序号)_____________;A.升高温度、增大压强均有利于提高氨的转化率B.铁触媒在该温度时活性大C.工业生产受动力、材料、设备等条件的限制③达到平衡后,若改变反应条件,会使平衡发生移动。图2表示随条件改变,氨气的百分含量的变化趋势。当横坐标为压强时,变化趋势正确的是(选填字母序列号)________;当横坐标为温度时,变化趋势正确的是(选填字母序列号)________;(2)设在2.0L密闭容器中充入0.6molN2(g)和1.6molH2(g),反应在一定条件下达到平衡时,NH3的物质的量分数为4/7,此时,N2的平衡转化率为________________。(3)常温下氨气极易溶于水,其水溶液可以导电。①用方程式表示氨气溶于水且氨水显弱碱性的过程:_______________________________________________________;②氨水中水电离出的c(OH)______10mol·L(填写“>”,“<”或“=”);③将相同体积、相同物质的量浓度的氨水和盐酸混合后,溶液中离子浓度由大到小依次为____________________________________________。10.(本题15分)下面两图中的各物质均是中学化学中的常见物质。在各转化关系中,有的反应生成的水未标出。C是一种重要的化工产品。E是一种常用化肥,J是目前世界上应用范围和用量最大的金属。每1molG与I均含有10mole,每1molX与D均含有18mole。H是空气的主要成分之一,B是大气的主要污染物之一,且M与N的组成元素相同。回答下列问题:(1)X的电子式为____________________;(2)写出反应①的化学方程式_____________________________________________;(3)...