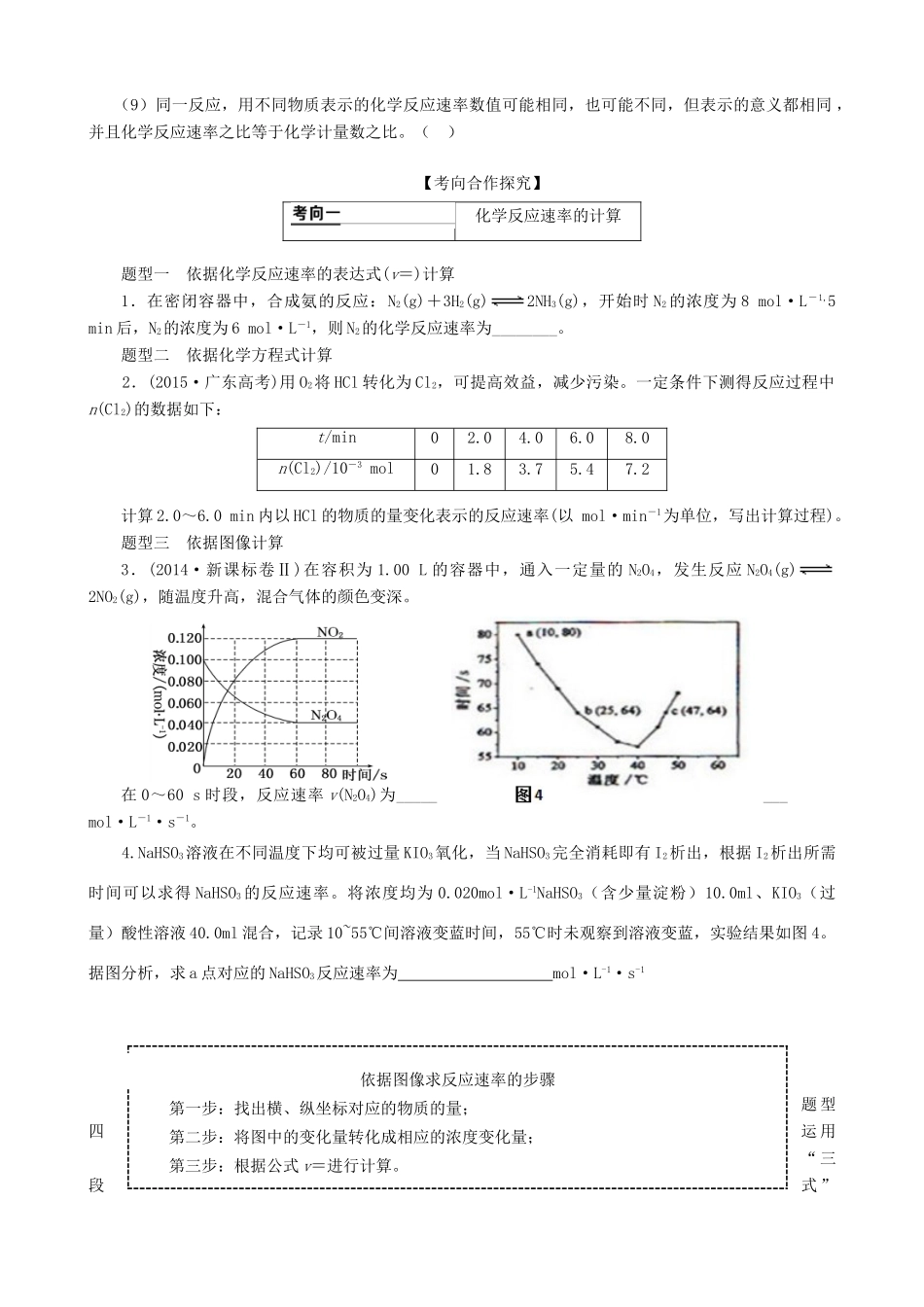
1.了解化学反应速率的概念、反应速率的定量表示方法。2.了解催化剂在生产、生活和科学领域中的重要作用。3.理解外界条件(浓度、温度、压强、催化剂等)对反应速率的影响,认识并能用相关理论解释其一般规律。专题一化学反应速率和化学平衡第一节化学反应速率及其影响因素考点一[基础自主落实]1.化学反应速率2.化学反应速率与化学计量数的关系(1)内容:对于已知反应mA(g)+nB(g)==pC(g)+qD(g),其化学反应速率可用不同的反应物或生成物来表示,当单位相同时,化学反应速率的数值之比等于方程式中各物质的之比,即v(A)∶v(B)∶v(C)∶v(D)=。(2)实例:一定温度下,在密闭容器中发生反应:3A(g)+B(g)==2C(g)。已知v(A)=0.6mol·L-1·s-1,则v(B)=mol·L-1·s-1,v(C)=mol·L-1·s-1。【自我检测】1.判断正误(正确的打“√”,错误的打“×”)。(1)同一反应,在相同时间间隔内,用不同物质表示的反应速率,其数值和意义都不一定相同()(2)10mol·L-1·s-1的反应速率一定比1mol·L-1·s-1的反应速率大()(3)固体和纯液体的浓度是固定的,增加固体或纯液体的用量,反应速率保持不变()(4)对于某可逆反应,反应进行的净速率是正、逆反应速率之差()(5)化学反应速率表示的是化学反应进行的限度()(6)化学反应速率可以是正值,也可以是负值()(7)对于任何化学反应来说,反应速率越快,反应现象就越明显()(8)在2SO2(g)+O2(g)2SO3(g)反应中,t1、t2时刻,SO3(g)浓度分别是c1、c2,则t1~t2时间内,SO3(g)生成的平均速率为v=()(9)同一反应,用不同物质表示的化学反应速率数值可能相同,也可能不同,但表示的意义都相同,并且化学反应速率之比等于化学计量数之比。()【考向合作探究】化学反应速率的计算题型一依据化学反应速率的表达式(v=)计算1.在密闭容器中,合成氨的反应:N2(g)+3H2(g)2NH3(g),开始时N2的浓度为8mol·L-1,5min后,N2的浓度为6mol·L-1,则N2的化学反应速率为________。题型二依据化学方程式计算2.(2015·广东高考)用O2将HCl转化为Cl2,可提高效益,减少污染。一定条件下测得反应过程中n(Cl2)的数据如下:t/min02.04.06.08.0n(Cl2)/10-3mol01.83.75.47.2计算2.0~6.0min内以HCl的物质的量变化表示的反应速率(以mol·min-1为单位,写出计算过程)。题型三依据图像计算3.(2014·新课标卷Ⅱ)在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)2NO2(g),随温度升高,混合气体的颜色变深。在0~60s时段,反应速率v(N2O4)为________mol·L-1·s-1。4.NaHSO3溶液在不同温度下均可被过量KIO3氧化,当NaHSO3完全消耗即有I2析出,根据I2析出所需时间可以求得NaHSO3的反应速率。将浓度均为0.020mol·L-1NaHSO3(含少量淀粉)10.0ml、KIO3(过量)酸性溶液40.0ml混合,记录10~55℃间溶液变蓝时间,55℃时未观察到溶液变蓝,实验结果如图4。据图分析,求a点对应的NaHSO3反应速率为mol·L-1·s-1题型四运用“三段式”依据图像求反应速率的步骤第一步:找出横、纵坐标对应的物质的量;第二步:将图中的变化量转化成相应的浓度变化量;第三步:根据公式v=进行计算。进行化学反应速率的计算4.NH3和纯净的O2在一定条件下发生反应:4NH3(g)+3O2(g)2N2(g)+6H2O(g),现向一容积不变的2L密闭容器中充入4molNH3和3molO2,4min后,测得生成的H2O占混合气体体积的40%,则下列表示此段时间内该反应的平均速率不正确的是()A.v(N2)=0.125mol·L-1·min-1B.v(H2O)=0.375mol·L-1·min-1C.v(O2)=0.225mol·L-1·min-1D.v(NH3)=0.250mol·L-1·min-1“三段式”法的解题模式对于反应mA(g)+nB(g)pC(g)+qD(g),起始(t0s)时A的浓度为amol·L-1,B的浓度为bmol·L-1,反应进行至t1s时,A消耗了xmol·L-1,则化学反应速率可计算如下:mA(g)+nB(g)pC(g)+qD(g)t0s/(mol·L-1)ab00转化/(mol·L-1)xt1s/(mol·L-1)a-xb-则:v(A)=mol·L-1·s-1,v(B)=mol·L-1·s-1,v(C)=mol·L-1·s-1,v(D)=mol·L-1·s-1。题型一根据“定量法”判断不同条件下反应速率的大小5.已知反应4CO+2NO2N2+4CO2在不同条件下的化学反应速率如下...