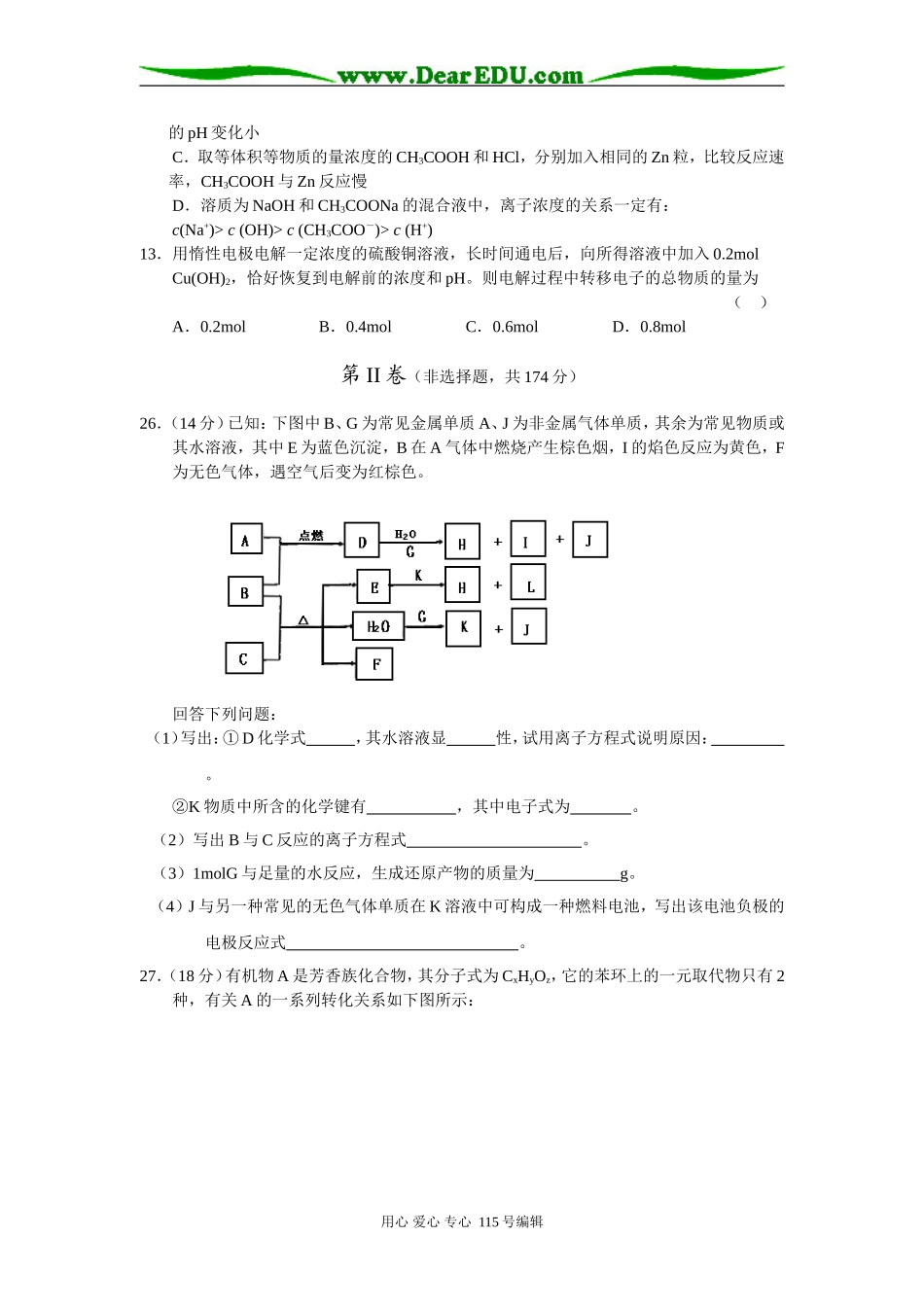
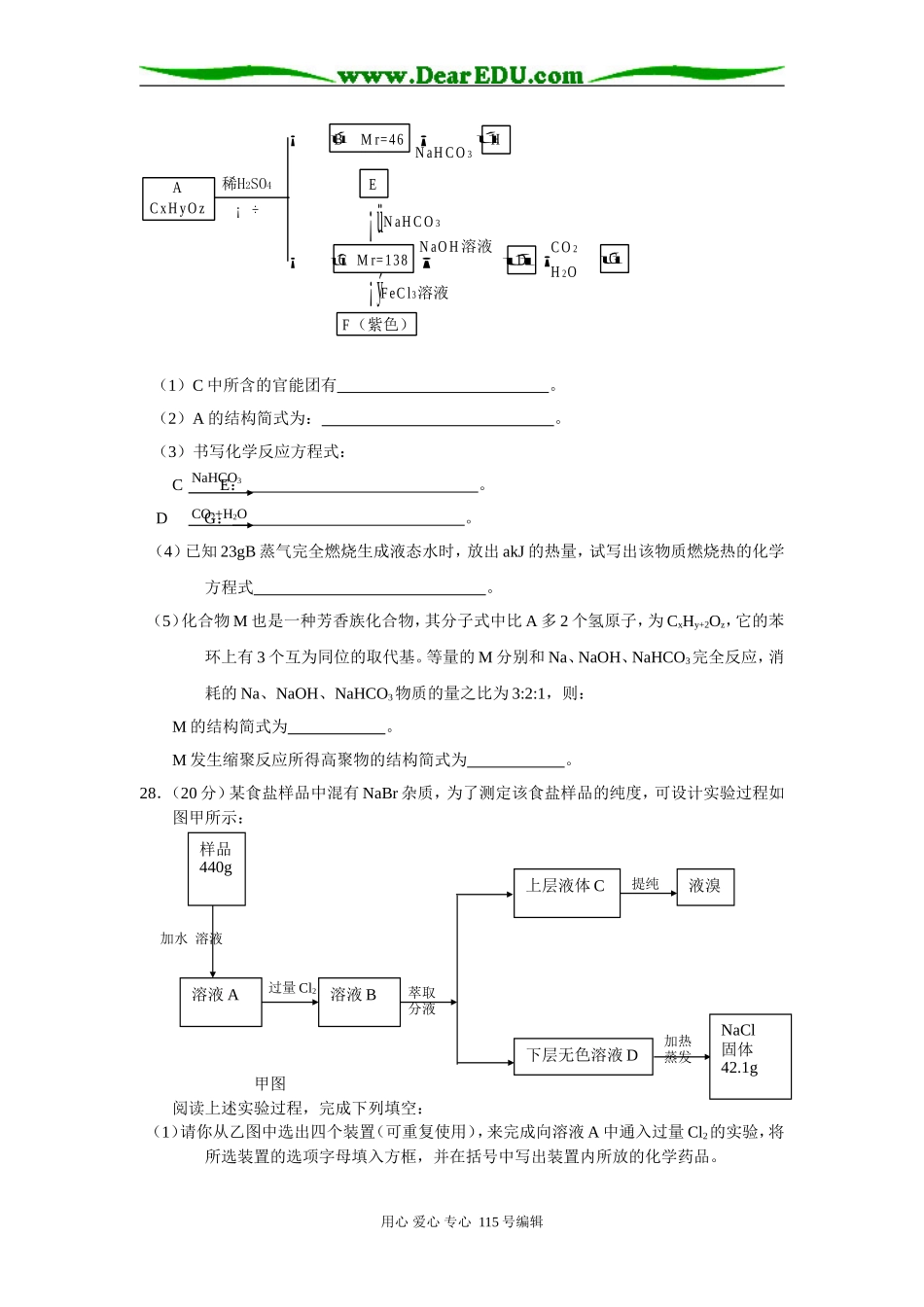
浙江省武义第一中学高三化学“8+4”考前训练(九)7.下列有关叙述中正确的是()A.胶体产生丁达尔效应是由胶粒的大小决定的B.同一主族元素的氢化物,相对分子质量越大,它的沸点一定越高C.分子晶体溶于水时,一定不破坏共价键D.同位素的质量数不同,物理性质不同,同位素的不同原子构成的单质化学性质也不相同8.若NA为阿伏加德罗常数的值,下列说法中正确的是()A.常温常压下,22.4LN2和NO的混合气体所含的原子数为2NAB.在反应CaO+3CCaC2+CO↑中,生成1molCO,转移的电子数为3NAC.在10.6gNa2CO3晶体中,Na+和CO的数目比为2:1D.1molNH中含电子数为9NA9.下列离子方程式书写正确的是()A.等物质的量浓度的FeBr2和CuCl2混合溶液用惰性电极电解,最初发生:Fe2++2Cl-Fe+Cl2↑B.硫酸亚铁加入到过氧化氢溶液中:Fe2++H2O2+2H+=Fe3++4H2OC.碳酸氢钙溶液中加入等物质的量的氢氧化钠溶液:Ca2++2HCO+2OH-=CaCO3↓+2H2O+COD.氯酸钾与浓盐酸制取少量氯气:6H++ClO+5Cl-3Cl2↑+3H2O10.对于反应2SO2(g)+O2(g)2SO3(g);△H<0已达平衡,如果其他条件不变时,分别改变下列条件,对化学反应速率和化学平衡产生影响,下列条件与图像不相符的是()(0~t1;v正=v逆;t1时改变条件,t2时重新建立平衡。)A.增加氧气的浓度B.增大压强C.升高温度D.加入催化剂11.下列有关化学反应的描述正确的是()A.将足量稀盐酸加到Mg、AlCl3、NaAlO2组成的固体混合物中,只能发生一种反应B.把盛有等物质的量的一氧化氮和二氧化氮的混合气体的试管倒置于水槽中,最后剩余气体理论上为原来气体体积的2/3C.稀硝酸与铁反应时产物与反应物的量有关,当n(Fe):n(HNO3)≥3:8时产物为Fe3+D.甘氨酸和(NH4)2s都既能与盐酸反应,又能与NaOH溶液反应且都有气体生成12.下列说法不正确的是()A.0.1mol/L的Na2CO3溶液中:c(OH-)=c(H+)+c(HCO)+2c(H2CO3)B.分别取等体积等pH的CH3COOH和HCl,都稀释相同的倍数后测pH,CH3COOH用心爱心专心115号编辑电解的pH变化小C.取等体积等物质的量浓度的CH3COOH和HCl,分别加入相同的Zn粒,比较反应速率,CH3COOH与Zn反应慢D.溶质为NaOH和CH3COONa的混合液中,离子浓度的关系一定有:c(Na+)>c(OH)>c(CH3COO-)>c(H+)13.用惰性电极电解一定浓度的硫酸铜溶液,长时间通电后,向所得溶液中加入0.2molCu(OH)2,恰好恢复到电解前的浓度和pH。则电解过程中转移电子的总物质的量为()A.0.2molB.0.4molC.0.6molD.0.8mol第II卷(非选择题,共174分)26.(14分)已知:下图中B、G为常见金属单质A、J为非金属气体单质,其余为常见物质或其水溶液,其中E为蓝色沉淀,B在A气体中燃烧产生棕色烟,I的焰色反应为黄色,F为无色气体,遇空气后变为红棕色。回答下列问题:(1)写出:①D化学式,其水溶液显性,试用离子方程式说明原因:。②K物质中所含的化学键有,其中电子式为。(2)写出B与C反应的离子方程式。(3)1molG与足量的水反应,生成还原产物的质量为g。(4)J与另一种常见的无色气体单质在K溶液中可构成一种燃料电池,写出该电池负极的电极反应式。27.(18分)有机物A是芳香族化合物,其分子式为CxHyOz,它的苯环上的一元取代物只有2种,有关A的一系列转化关系如下图所示:用心爱心专心115号编辑2007ACxHyOz稀H2SO4BMr=46NaHCO3HCMr=138EF(紫色)FeCl3溶液NaOH溶液NaHCO3DGCO2H2O¡ú¡ü¡ý¡ú¡ú¡ú¡ú¡÷(1)C中所含的官能团有。(2)A的结构简式为:。(3)书写化学反应方程式:CE:。DG:。(4)已知23gB蒸气完全燃烧生成液态水时,放出akJ的热量,试写出该物质燃烧热的化学方程式。(5)化合物M也是一种芳香族化合物,其分子式中比A多2个氢原子,为CxHy+2Oz,它的苯环上有3个互为同位的取代基。等量的M分别和Na、NaOH、NaHCO3完全反应,消耗的Na、NaOH、NaHCO3物质的量之比为3:2:1,则:M的结构简式为。M发生缩聚反应所得高聚物的结构简式为。28.(20分)某食盐样品中混有NaBr杂质,为了测定该食盐样品的纯度,可设计实验过程如图甲所示:加水溶液甲图阅读上述实验过程,完成下列填空:(1)请你从乙图中选出四个装置(可重复使用),来完成向...