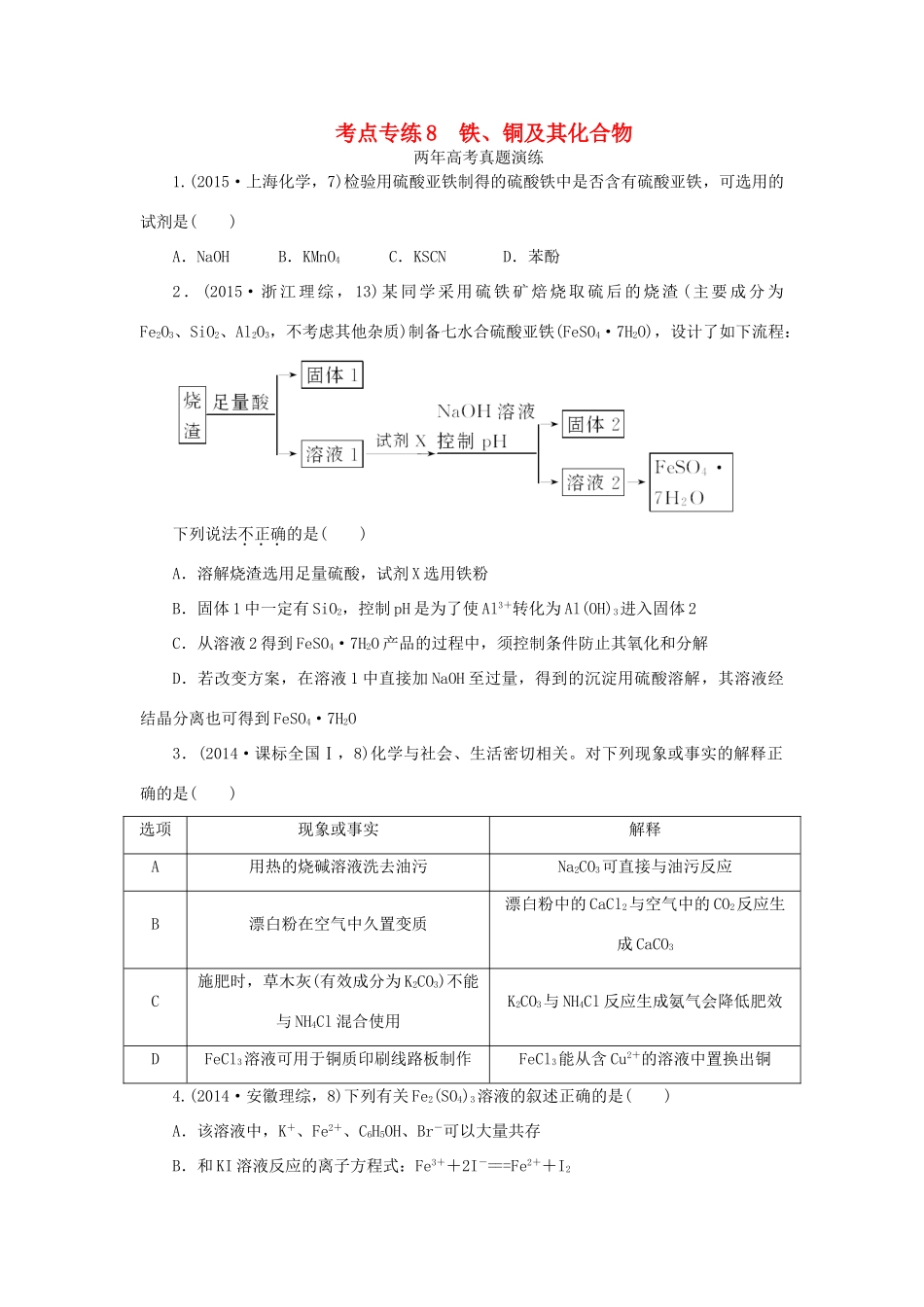
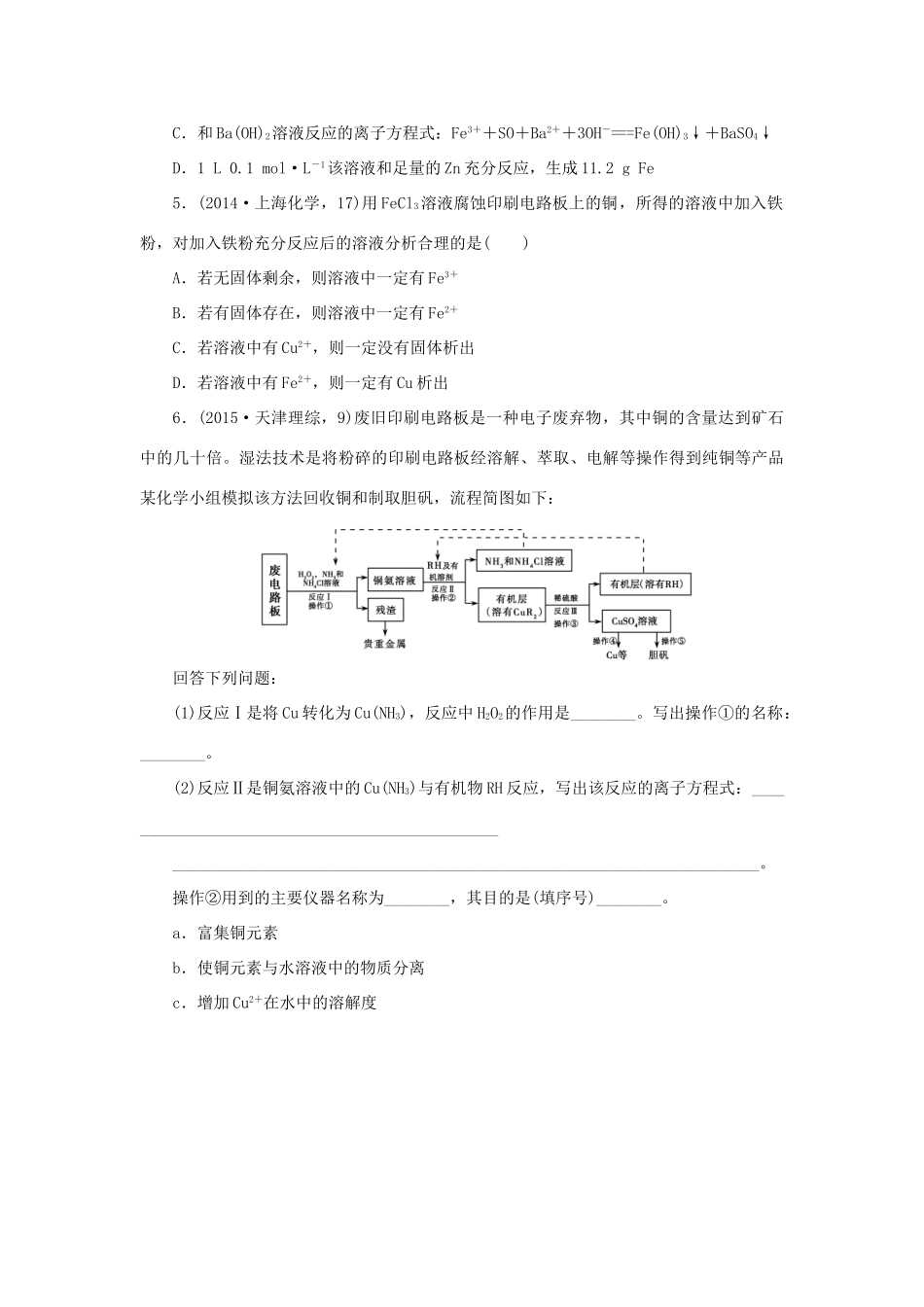
考点专练8铁、铜及其化合物两年高考真题演练1.(2015·上海化学,7)检验用硫酸亚铁制得的硫酸铁中是否含有硫酸亚铁,可选用的试剂是()A.NaOHB.KMnO4C.KSCND.苯酚2.(2015·浙江理综,13)某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质)制备七水合硫酸亚铁(FeSO4·7H2O),设计了如下流程:下列说法不正确的是()A.溶解烧渣选用足量硫酸,试剂X选用铁粉B.固体1中一定有SiO2,控制pH是为了使Al3+转化为Al(OH)3进入固体2C.从溶液2得到FeSO4·7H2O产品的过程中,须控制条件防止其氧化和分解D.若改变方案,在溶液1中直接加NaOH至过量,得到的沉淀用硫酸溶解,其溶液经结晶分离也可得到FeSO4·7H2O3.(2014·课标全国Ⅰ,8)化学与社会、生活密切相关。对下列现象或事实的解释正确的是()选项现象或事实解释A用热的烧碱溶液洗去油污Na2CO3可直接与油污反应B漂白粉在空气中久置变质漂白粉中的CaCl2与空气中的CO2反应生成CaCO3C施肥时,草木灰(有效成分为K2CO3)不能与NH4Cl混合使用K2CO3与NH4Cl反应生成氨气会降低肥效DFeCl3溶液可用于铜质印刷线路板制作FeCl3能从含Cu2+的溶液中置换出铜4.(2014·安徽理综,8)下列有关Fe2(SO4)3溶液的叙述正确的是()A.该溶液中,K+、Fe2+、C6H5OH、Br-可以大量共存B.和KI溶液反应的离子方程式:Fe3++2I-===Fe2++I2C.和Ba(OH)2溶液反应的离子方程式:Fe3++SO+Ba2++3OH-===Fe(OH)3↓+BaSO4↓D.1L0.1mol·L-1该溶液和足量的Zn充分反应,生成11.2gFe5.(2014·上海化学,17)用FeCl3溶液腐蚀印刷电路板上的铜,所得的溶液中加入铁粉,对加入铁粉充分反应后的溶液分析合理的是()A.若无固体剩余,则溶液中一定有Fe3+B.若有固体存在,则溶液中一定有Fe2+C.若溶液中有Cu2+,则一定没有固体析出D.若溶液中有Fe2+,则一定有Cu析出6.(2015·天津理综,9)废旧印刷电路板是一种电子废弃物,其中铜的含量达到矿石中的几十倍。湿法技术是将粉碎的印刷电路板经溶解、萃取、电解等操作得到纯铜等产品某化学小组模拟该方法回收铜和制取胆矾,流程简图如下:回答下列问题:(1)反应Ⅰ是将Cu转化为Cu(NH3),反应中H2O2的作用是________。写出操作①的名称:________。(2)反应Ⅱ是铜氨溶液中的Cu(NH3)与有机物RH反应,写出该反应的离子方程式:________________________________________________________________________________________________________________________。操作②用到的主要仪器名称为________,其目的是(填序号)________。a.富集铜元素b.使铜元素与水溶液中的物质分离c.增加Cu2+在水中的溶解度(3)反应Ⅲ是有机溶液中的CuR2与稀硫酸反应生成CuSO4和________。若操作③使用右图装置,图中存在的错误是________。(4)操作④以石墨作电极电解CuSO4溶液。阴极析出铜,阳极产物是________。操作⑤由硫酸铜溶液制胆矾的主要步骤是________________________________________________________________________。(5)流程中有三处实现了试剂的循环使用,已用虚线标出两处,第三处的试剂是________。循环使用的NH4Cl在反应Ⅰ中的主要作用是________________________________________________________________________。考点专练8铁、铜及其化合物一年模拟试题精练1.(2015·兰州质检,5)某同学通过系列实验,探究Cu及其化合物的性质,下列操作正确且能达到目的的是()A.将铜粉和硫粉混合均匀加热以制取CuSB.将Cu片放入过量浓硫酸中,一段时间后加水以观察CuSO4溶液的颜色C.向CuSO4溶液中加入NaOH溶液,过滤洗涤并收集沉淀,加热以制取CuOD.设计Cu-Al-浓硝酸原电池,以证明金属活动性:Cu