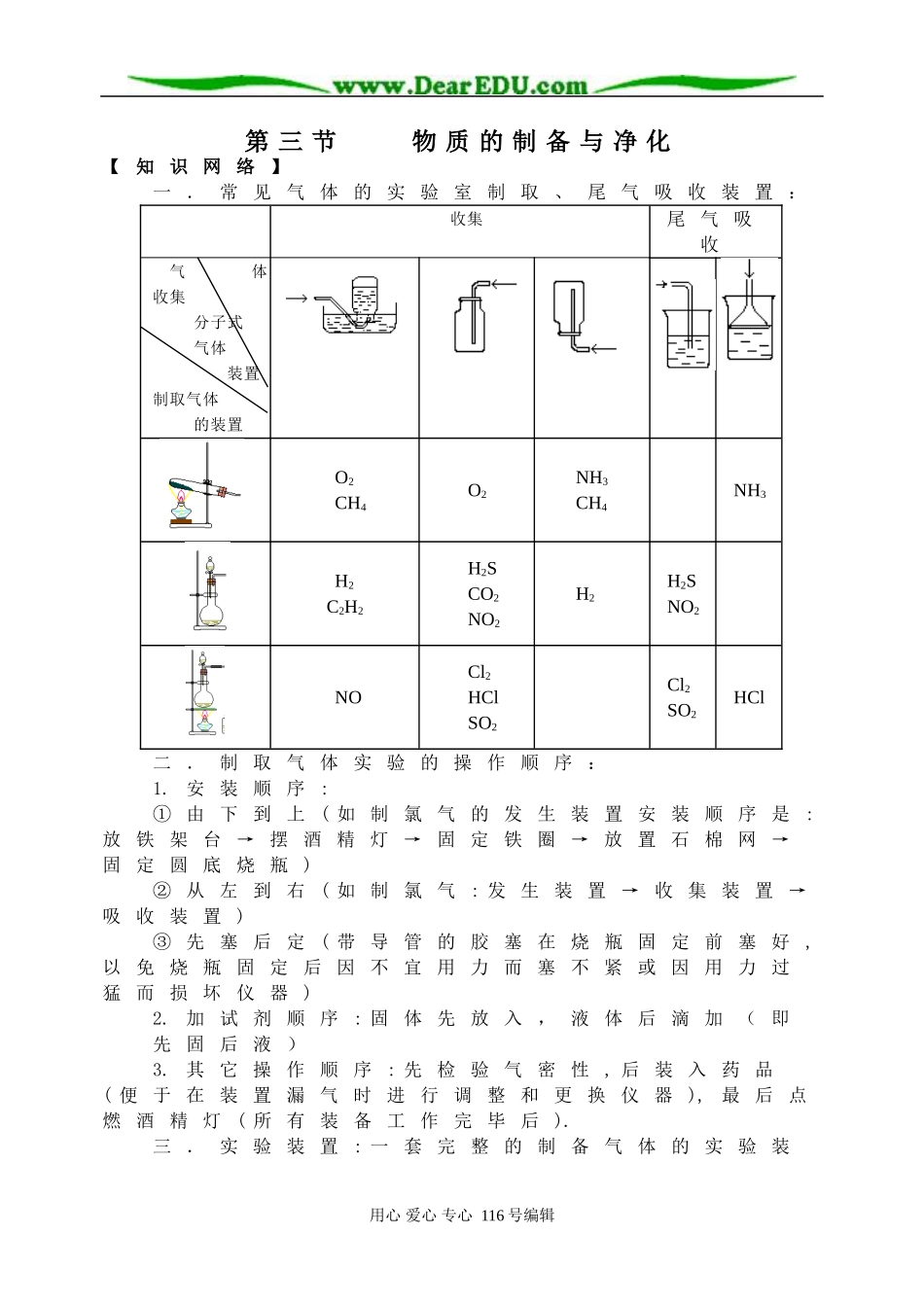
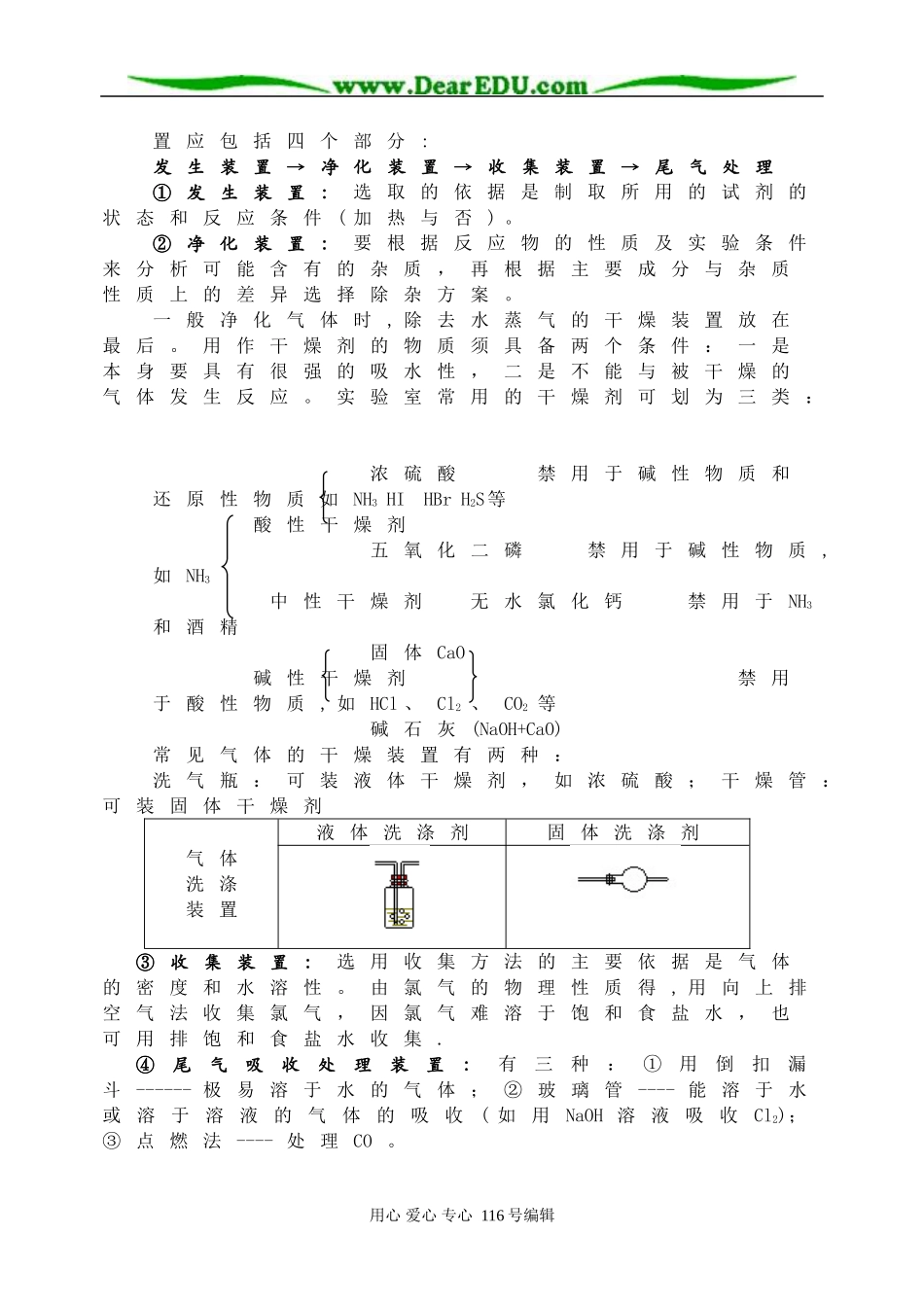
第三节物质的制备与净化【知识网络】一.常见气体的实验室制取、尾气吸收装置:收集尾气吸收气体收集分子式气体装置制取气体的装置O2CH4O2NH3CH4NH3H2C2H2H2SCO2NO2H2H2SNO2NOCl2HClSO2Cl2SO2HCl二.制取气体实验的操作顺序:1.安装顺序:①由下到上(如制氯气的发生装置安装顺序是:放铁架台→摆酒精灯→固定铁圈→放置石棉网→固定圆底烧瓶)②从左到右(如制氯气:发生装置→收集装置→吸收装置)③先塞后定(带导管的胶塞在烧瓶固定前塞好,以免烧瓶固定后因不宜用力而塞不紧或因用力过猛而损坏仪器)2.加试剂顺序:固体先放入,液体后滴加(即先固后液)3.其它操作顺序:先检验气密性,后装入药品(便于在装置漏气时进行调整和更换仪器),最后点燃酒精灯(所有装备工作完毕后).三.实验装置:一套完整的制备气体的实验装用心爱心专心116号编辑置应包括四个部分:发生装置→净化装置→收集装置→尾气处理①发生装置:选取的依据是制取所用的试剂的状态和反应条件(加热与否)。②净化装置:要根据反应物的性质及实验条件来分析可能含有的杂质,再根据主要成分与杂质性质上的差异选择除杂方案。一般净化气体时,除去水蒸气的干燥装置放在最后。用作干燥剂的物质须具备两个条件:一是本身要具有很强的吸水性,二是不能与被干燥的气体发生反应。实验室常用的干燥剂可划为三类:浓硫酸禁用于碱性物质和还原性物质如NH3HIHBrH2S等酸性干燥剂五氧化二磷禁用于碱性物质,如NH3中性干燥剂无水氯化钙禁用于NH3和酒精固体CaO碱性干燥剂禁用于酸性物质,如HCl、Cl2、CO2等碱石灰(NaOH+CaO)常见气体的干燥装置有两种:洗气瓶:可装液体干燥剂,如浓硫酸;干燥管:可装固体干燥剂气体洗涤装置液体洗涤剂固体洗涤剂③收集装置:选用收集方法的主要依据是气体的密度和水溶性。由氯气的物理性质得,用向上排空气法收集氯气,因氯气难溶于饱和食盐水,也可用排饱和食盐水收集.④尾气吸收处理装置:有三种:①用倒扣漏斗------极易溶于水的气体;②玻璃管----能溶于水或溶于溶液的气体的吸收(如用NaOH溶液吸收Cl2);③点燃法----处理CO。用心爱心专心116号编辑【易错指津】1.对气体制取、除杂、干燥、收集、转化要进行整体思考。2.气密性检查:可用加热法或水封法,不论哪种方法,事先都要确保系统是密封的。3.理解启普发生器使用条件,明确C2H2、SO2不能用该仪器制取。4.气体的收集:①因为C2H2、C2H4的气体密度很接近空气,所以不宜用向下排气法收集;②因为NO极易与空气中氧气反应生成NO2所以只能用排水法收集。5.对于NH3和HCl这2种污染性气体的尾气吸收装置要选用倒置的漏斗。6.克服思维定势:①除课本制气方法外,也可有其它方法。如用Na2O2和H2O、MnO2和H2O2制O2(装置同制C2H2);②了解制气装置替代方法,如用U形管或干燥管制CO2;③气体的收集也可用球胆或气球来收集。7.要区分气体的吸收和检验两种不同的操作,例如,要检验CO2,是通过澄清石灰水;要吸收CO2,则是通过NaOH溶液。检验要求灵敏、现象明显;而吸收则要求反应迅速、完全。【典型例题评析】例1下列反应适用于实验室制备氧气的是(1994年全国高考题)①高锰酸钾热分解2KMnO4K2MnO4+MnO2+O2↑②硝酸铵热分解2NH4NO34H2O+N2↑+O2↑③过氧化催化分解2H2O22H2O+O2↑④二氧化氮热分解2NO22NO+O2↑A.只有①B.①和②C.①和③D.①③④思路分析:回答本题,首先需要考生通过几年的化学学习,体会到物质的实验室制法所必须具备的基本要求和条件。一般来说,物质的实验室制法(尤其是中学)所要求的条件大致为:反应尽可能快一些反应条件尽可能简单,操作比较易行,尽量使制备的产物单一易于分离;而对反应物的成本、能耗,可以较少考虑,尽可能使用常用的仪器设备,如试管、烧瓶、烧杯等等。反应较为安全或安全性可控。用心爱心专心116号编辑△△MnO2△在本题所给的4个反应中,除了KMnO4热分解反应是众所周知实验室里O2的制法之外,H2O2分解也可以方便地用于实验室制备O2。为此,可将MnO2置于一只烧瓶内,从分液漏斗中滴入H2O2立即有O2发生,并可用控制滴速的方法来调节产生O2的气流量。NH4NO3不行,一是其受热温度不同分解产物不同,二是即使发生题中指定...