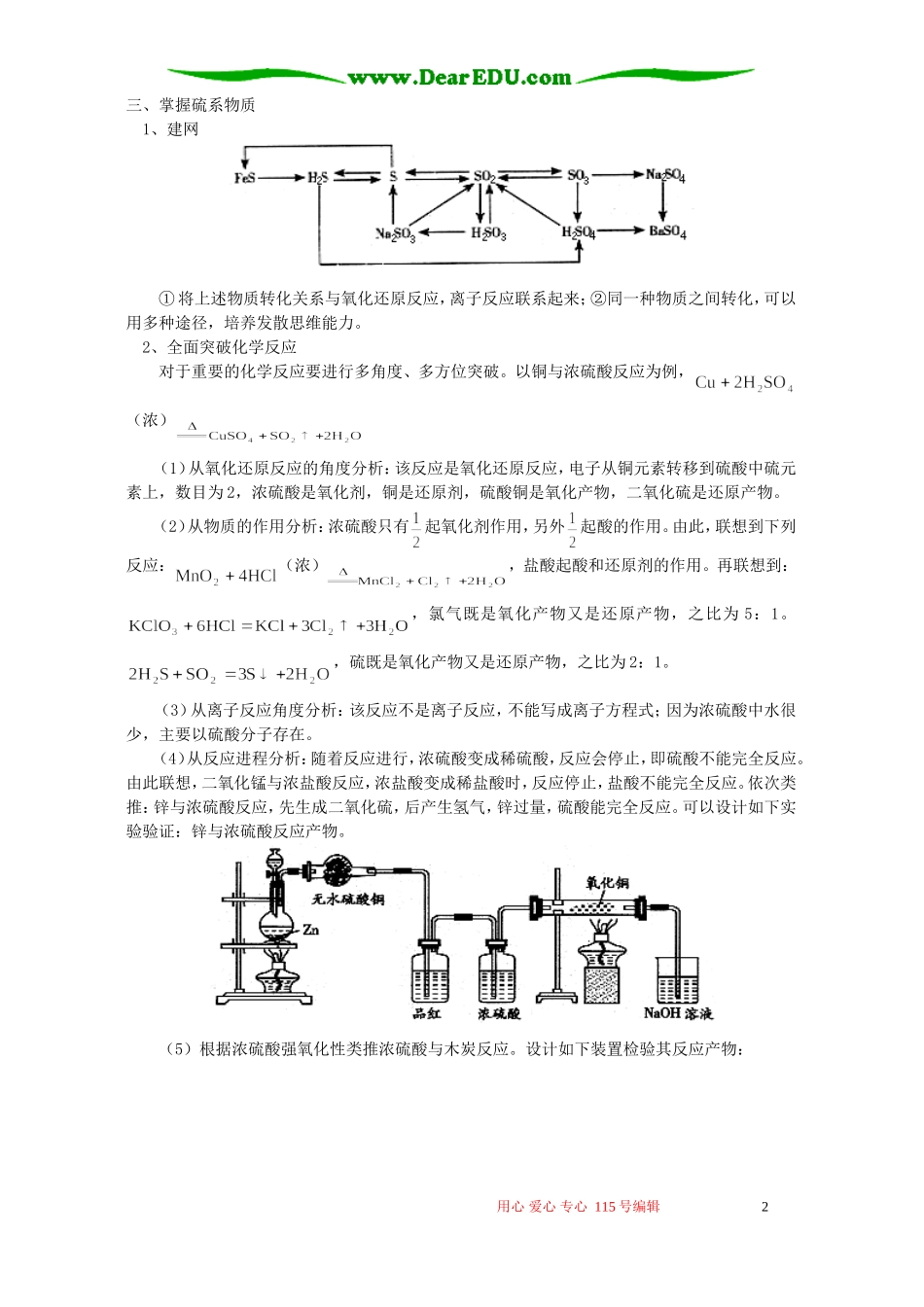
多角度复习教材知识陈世华一、理清位—构—性关系1、结构结构决定性质,重点掌握1~20号元素原子结构示意图,碱金属、卤素、氧族元素原子结构特点,从原子结构出发,把握元素主要化合价、原子半径、元素分类等信息。掌握常见元素结构特点,如电子层数等于最外层电子数的有氢、铍、铝等。2、位置根据元素原子结构确定元素在周期表中位置,熟练掌握元素在周期表中的位置;反过来,可以从元素在周期表中位置推断元素原子结构。3、性质:(1)根据元素在周期表中位置,确定元素相关性质。例如,16号元素→它位于第三周期第VIA族→它属于非金属,最高化合价为+6,最低化合价为-2价,典型物质:单质为S,氢化物为,最高价氧化物为,最高价含氧酸有,典型含氧酸盐有,无氧酸盐有等。另外,也是重要的二元中强酸。(2)整合其他族元素,如氧族元素与卤素、碱金属元素整合。例如,设计方案验证氯非金属性强于硫:至少可以通过下列方法比较:①根据元素在周期表中位置判断,氯和硫原子层数相同,氯质子数为17,最外层有7个电子,硫质子数为16,最外层有6个电子,所以氯原子半径小于硫的半径,氯的非金属性比硫强;②根据高价含氧酸的酸性判断:高氯酸是酸王,酸性:,高价含氧酸的酸性越强,对应的非金属元素(中心元素:除H、O外)的非金属性越强;③比较气态氢化物稳定性:氯化氢很稳定,而硫化氢易分解;④比较非金属单质与氢气反应难易程度:硫与氢气在高温下反应,而氯气与氢气在光照下化合;⑤比较非金属单质与同一种变价金属反应:氯气与铁反应生成氯化铁,而硫与铁反应生成硫化亚铁。氯气与铜反应生成氯化铜,而硫与铜生成硫化亚铜等。二、运用元素周期表1、周期要求掌握短周期元素原子结构、位置。其中氢、碳、氮、氧、钠、镁、铝、硅、磷、硫、氯作为重点,锂、氟、稀有气体作为了解,铍、硼作为新信息了解。了解短周期元素结构特点,10电子、14电子和18电子微粒。在元素推断题中,主要考查了短周期元素。2、主族:要求熟悉主族元素的名称、在周期表中位置,根据原子序数能推断元素在周期表中位置。例如,铋、铊、铅、锗、硒;还要求会推断未知元素如114、116号元素在周期表中位置。会写出IA族、VIA族和VIIIA族元素氧化物、高价氧化物对应的水化物、氢化物、盐的化学式。重点掌握每个主族的代表元素:如氧族元素代表是硫。3、典型元素高考大纲重点要求六种元素(铝、铁、钠,氯、氮和硫),了解镁、钙、锂,铜等。近几年高考关注了铅、铊、钛、铬等金属,主要从安全和新材料角度切入。4、递变规律元素周期律指导我们学习元素化合物知识。熟练掌握同主族和同周期元素,①元素性质(原子半径、原子序数、最外层电子数、主要化合价、金属性和非金属性)递变规律;②气态氢化物的递变规律,同主族从上至下气态氢化物稳定性减弱、水溶液酸性增强、还原性增强;同周期,从左至右:气态氢化物稳定性增强,水溶液酸性增强;③高价氧化物对应的水化物:同周期从左至右,碱性减弱,酸性增强;同主族从上至下,碱性增强,酸性减弱。5、“三线”①对角线:短周期中处于对角线的三组元素:锂—镁,铍—铝,硼—硅,对应元素及其化合物的性质相似,例如,氢氧化镁和氢氧化锂难溶,碳酸锂和碳酸镁微溶,铍和铝都能与氢氧化钠和盐酸反应。②边界线:要求会画元素周期表的边界线(2006年高考考查);③会画金属与非金属分界线(2005年上海高考),分界线附近的元素具有金属性和非金属两性。用心爱心专心115号编辑1三、掌握硫系物质1、建网①将上述物质转化关系与氧化还原反应,离子反应联系起来;②同一种物质之间转化,可以用多种途径,培养发散思维能力。2、全面突破化学反应对于重要的化学反应要进行多角度、多方位突破。以铜与浓硫酸反应为例,(浓)(1)从氧化还原反应的角度分析:该反应是氧化还原反应,电子从铜元素转移到硫酸中硫元素上,数目为2,浓硫酸是氧化剂,铜是还原剂,硫酸铜是氧化产物,二氧化硫是还原产物。(2)从物质的作用分析:浓硫酸只有起氧化剂作用,另外起酸的作用。由此,联想到下列反应:(浓),盐酸起酸和还原剂的作用。再联想到:,氯气既是氧化产物又是还原产物...