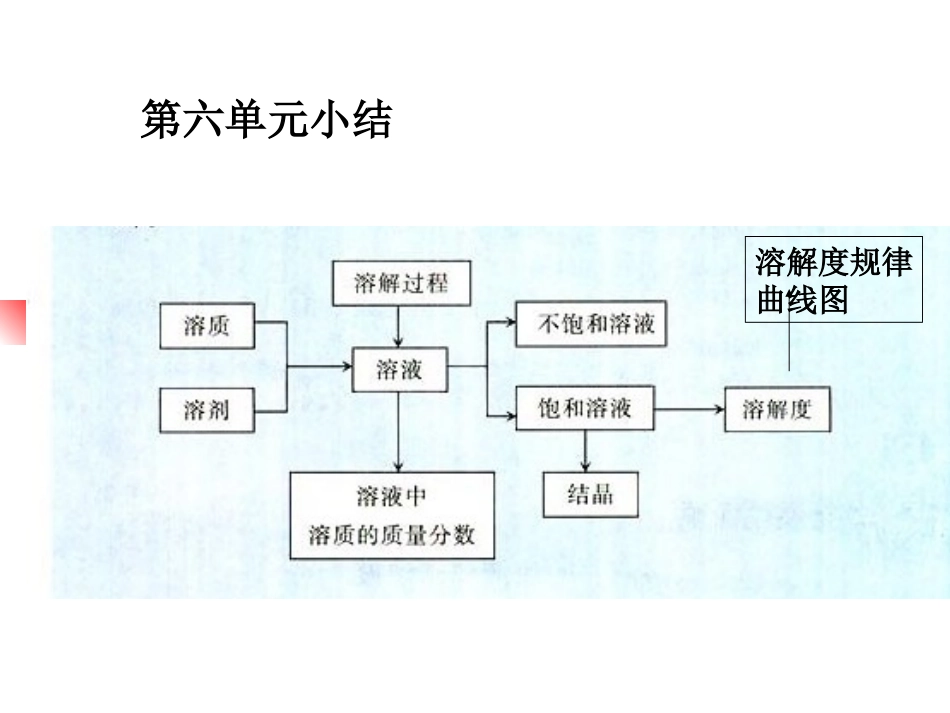
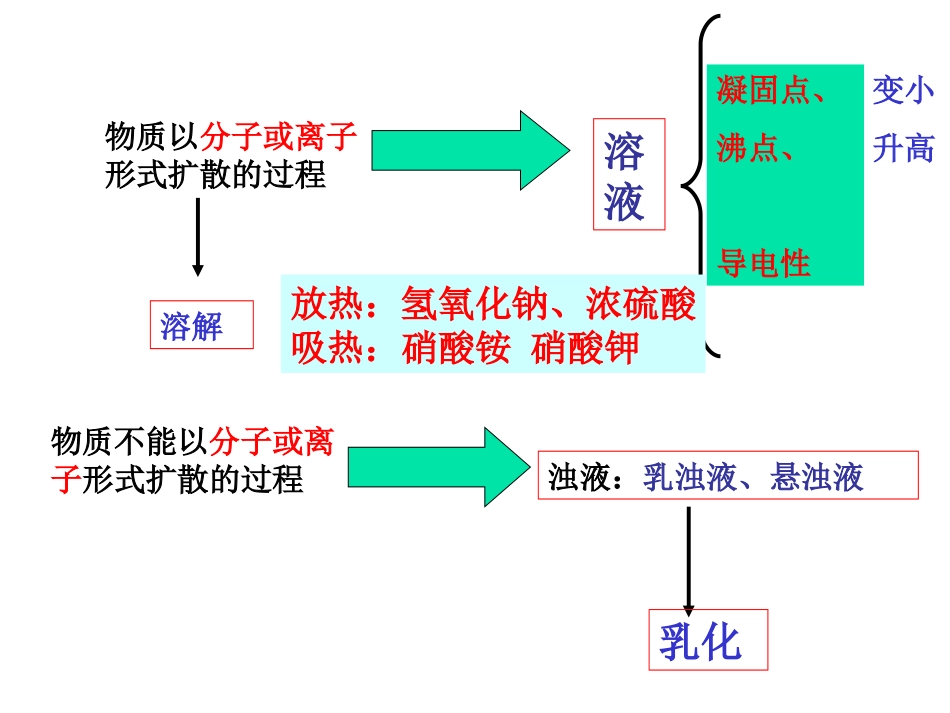
第六单元小结溶解度规律曲线图物质以分子或离子形式扩散的过程溶液浊液:乳浊液、悬浊液凝固点、沸点、导电性放热:氢氧化钠、浓硫酸吸热:硝酸铵硝酸钾物质不能以分子或离子形式扩散的过程溶解乳化变小升高1.溶液定义:定义:一种或几种物质分散到另一种物质里,一种或几种物质分散到另一种物质里,形成均一的、稳定的混合物就是溶液。形成均一的、稳定的混合物就是溶液。溶质溶质溶剂溶剂均一均一····稳定稳定····混合物混合物⑶⑶溶液是由溶液是由溶质溶质和和溶剂溶剂所组成。所组成。能溶解其他物质的能溶解其他物质的物质叫做溶剂。物质叫做溶剂。被溶解的被溶解的物质叫做溶物质叫做溶质;质;⑴⑴溶液的特征是:溶液的特征是:均一性、稳定性均一性、稳定性。。⑵溶液是混合物混合物。溶液组成的判断1、典型溶液:稀盐酸、石灰水、碘酒、稀硫酸、植物油的汽油溶液2、放入水中变化的物质:氧化钙溶质:。Ca(OH)2CuSO4.5H2OCuSO42.溶液的性质—沸点凝固点导电性的条件:电子离子导电的物质:金属和石墨(自由移动的电子)部分溶液(自由移动的离子)1、判断下列物质是否导电?NaOH固体食盐固体HCl的水溶液KNO3固体KNO3溶液蔗糖溶液酒精溶液要求有自由移动的带电微粒氯化钠溶于水微观示意图微粒种类:水分子钠离子氯离子定义饱和溶液:在一定温度下,在一定量的溶剂里不能再溶解某种溶质的溶液叫做这种溶质的饱和溶液.不饱和溶液:还能再继续溶解某种溶质的溶液3.饱和溶液与不饱和溶液判断方法:1.有无晶体析出2.再加溶质能否继续溶解饱和溶液与不饱和溶液的转化:降低温度饱和溶液增加溶剂升高温度蒸发溶剂增加溶质不饱和溶液需要注意:溶液是否饱和与浓稀没有直接关系。1.浓溶液可以是不饱和溶液,比如酒精溶液2.稀溶液可以是饱和溶液,比如氢氧化钙溶液3.饱和溶液一定是该温度下的浓溶液定义:4.影响物质溶解性的因素(1)不同物质在同一溶剂中溶解性不同(2)同一种物质在不同溶剂中溶解能力不同(3)同一种物质在同一溶剂中的溶解能力与温度有关溶质的性质溶剂的性质温度与溶质、溶剂的质量无关5.物质溶解性的定量表示——溶解度定义:在一定温度下,某固态物质在100克溶剂(通常是水)里达到饱和状态时所溶解溶质的质量。固体水100克够了,我饱了四要素条件:在一定温度下标准:在100克溶剂中状态:达到饱和状态单位:克陡升型曲线上的点:饱和溶液曲线下的点:不饱和溶液曲线上方的点:析出晶体213溶解度(克)温度(t)1601501401301201101009080706050403020102001901801701010090807060504030200硝酸铵硝酸钾硝酸钠氯化铵氯化钠硼酸6.固体溶解度曲线及意义点:点:曲线上的点均表曲线上的点均表示某物质在该温度下示某物质在该温度下的溶解度的溶解度。。交点:交点:曲线的交点表曲线的交点表示这两种物质在该温示这两种物质在该温度下的溶解度相同度下的溶解度相同。。曲线曲线::表示同一种物表示同一种物质在不同温度下的溶质在不同温度下的溶解度或溶解度随温度解度或溶解度随温度变化的情况变化的情况.a.b面面::线上是过饱和区,线上是过饱和区,线下是不饱和区。线下是不饱和区。3.溶质质量分数与溶解度关系区别和联系溶解度溶质质量分数区别概念表示意义条件状态联系一定温度时,100g溶剂中最多溶解溶质的质量任意溶剂中,溶质质量与溶液质量之比某物质溶解能力大小一定温度饱和状态任一溶液中溶质含量的多少不定温度可饱和,也可不饱和溶解度>溶质质量分数1、溶质质量分数=溶质质量溶液质量100%2、溶质质量=溶液质量×溶质质量分数3、溶液质量=溶质质量溶质质量分数4、溶液质量=溶液体积×密度5、溶质质量分数=溶解度100g+溶解度1.如右图所示,在盛冷水烧杯中放入甲、乙两支试管(试管中都有未溶解的该溶液的溶质),若使甲试管中晶体减少,乙试管中固体增加,需向烧杯中加入的物质是()A.氯化钠B.氢氧化钠固体C.冰块D.浓硫酸2.某10%硝酸钾溶液200克,平分两等份,变为20%的溶液方法1:加入10g硝酸钾方法2:蒸发掉一半的溶剂3,今欲配制100克20%的稀硫酸溶液需要98%的浓硫酸溶液(密度为:1.84克/毫升)多少毫升?水多少毫升?如图是A、B、C三...