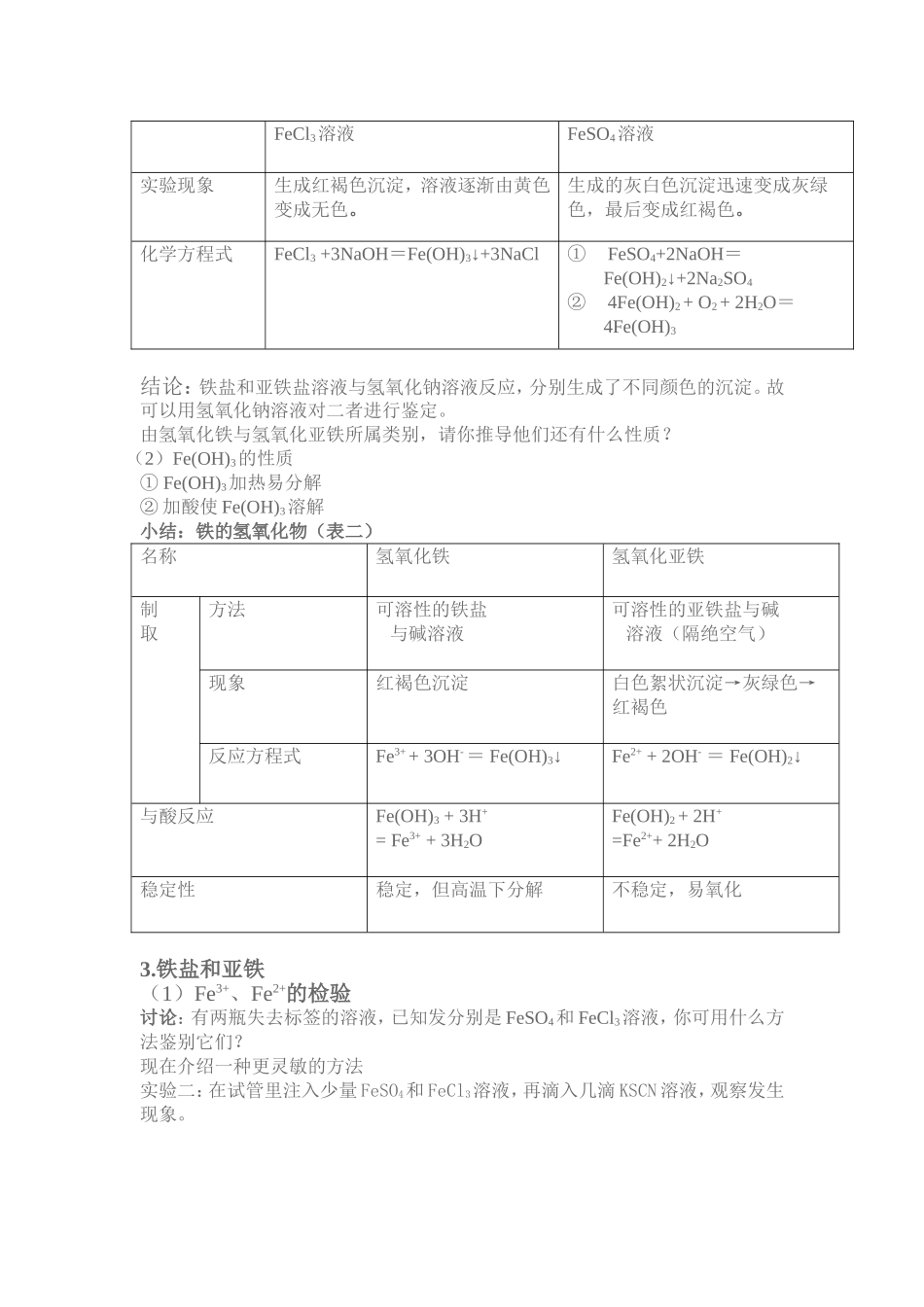
铁的重要化合物教学设计蔚小梅三维目标:1,了解 FeO、Fe2O3、Fe3O4的性质和用途,2,掌握 Fe(OH)2、 Fe(OH)3的制备和性质,3,掌握 Fe2+、Fe3+的检验方法及相互转化,4,培养科学探究的思维方式和能力.5,通过启发、诱导、观察、动手、讨论,提高学生思维能力和灵活分析、解决问题的能力。教学重点:铁的氧化物,氢氧化物的性质,Fe2+、Fe3+的相互转化教学难点:Fe(OH)2的制备,Fe2+、Fe3+的相互转化教学方式:实验-----探究教学过程引入:“小魔术铜片上写字”创设问题情境:我们已经学习了 Na2O Al2O3等金属氧化物的性质,那么能否推断铁的氧化物的性质呢?请同学们阅读课本 P59 页归纳,总结并完成下表的内容。1、铁的氧化物(表一)名称氧化亚铁 FeO氧化铁 Fe2O3四氧化三铁Fe3O4色、态黑色固体红棕色固体黑色晶体俗 称--------------铁红磁性氧化铁铁元素价态+2+3+2 ,+3溶解性不反应,不溶解与酸反应FeO+2HCl==FeCl2+H2OFe2O3+6HCl==2FeCl3+3H2O------------2. 铁的氢氧化物现有氢氧化钠、氯化铁、硫酸亚铁三种溶液,请你利用这些试剂先制备氢氧化铁,在制备氢氧化亚铁。观察、记录现象,并推导二者的性质。(1)实验探究一:FeCl3、FeSO4分别与 NaOH 的反应 FeCl3溶液FeSO4溶液实验现象生成红褐色沉淀,溶液逐渐由黄色变成无色。生成的灰白色沉淀迅速变成灰绿色,最后变成红褐色。化学方程式FeCl3 +3NaOH=Fe(OH)3↓+3NaCl ① FeSO4+2NaOH= Fe(OH)2↓+2Na2SO4② 4Fe(OH)2 + O2 + 2H2O= 4Fe(OH)3 结论:铁盐和亚铁盐溶液与氢氧化钠溶液反应,分别生成了不同颜色的沉淀。故可以用氢氧化钠溶液对二者进行鉴定。由氢氧化铁与氢氧化亚铁所属类别,请你推导他们还有什么性质?(2)Fe(OH)3的性质① Fe(OH)3加热易分解② 加酸使 Fe(OH)3溶解小结:铁的氢氧化物(表二)名称氢氧化铁氢氧化亚铁制取方法可溶性的铁盐 与碱溶液 可溶性的亚铁盐与碱 溶液(隔绝空气) 现象红褐色沉淀 白色絮状沉淀→灰绿色→红褐色 反应方程式Fe3+ + 3OH- = Fe(OH)3↓ Fe2+ + 2OH- = Fe(OH)2↓ 与酸反应Fe(OH)3 + 3H+ = Fe3+ + 3H2O Fe(OH)2 + 2H+ =Fe2++ 2H2O 稳定性稳定,但高温下分解 不稳定,易氧化 3.铁盐和亚铁(1)Fe3+、Fe2+的检验讨论:有两瓶失去标签的溶液,已知发分别是 FeSO4和 FeCl3溶液,你可用什么方法鉴别它们?现在介绍一种更灵敏的方法实验二:在试管里注入少量 FeSO4和 FeCl3溶液...