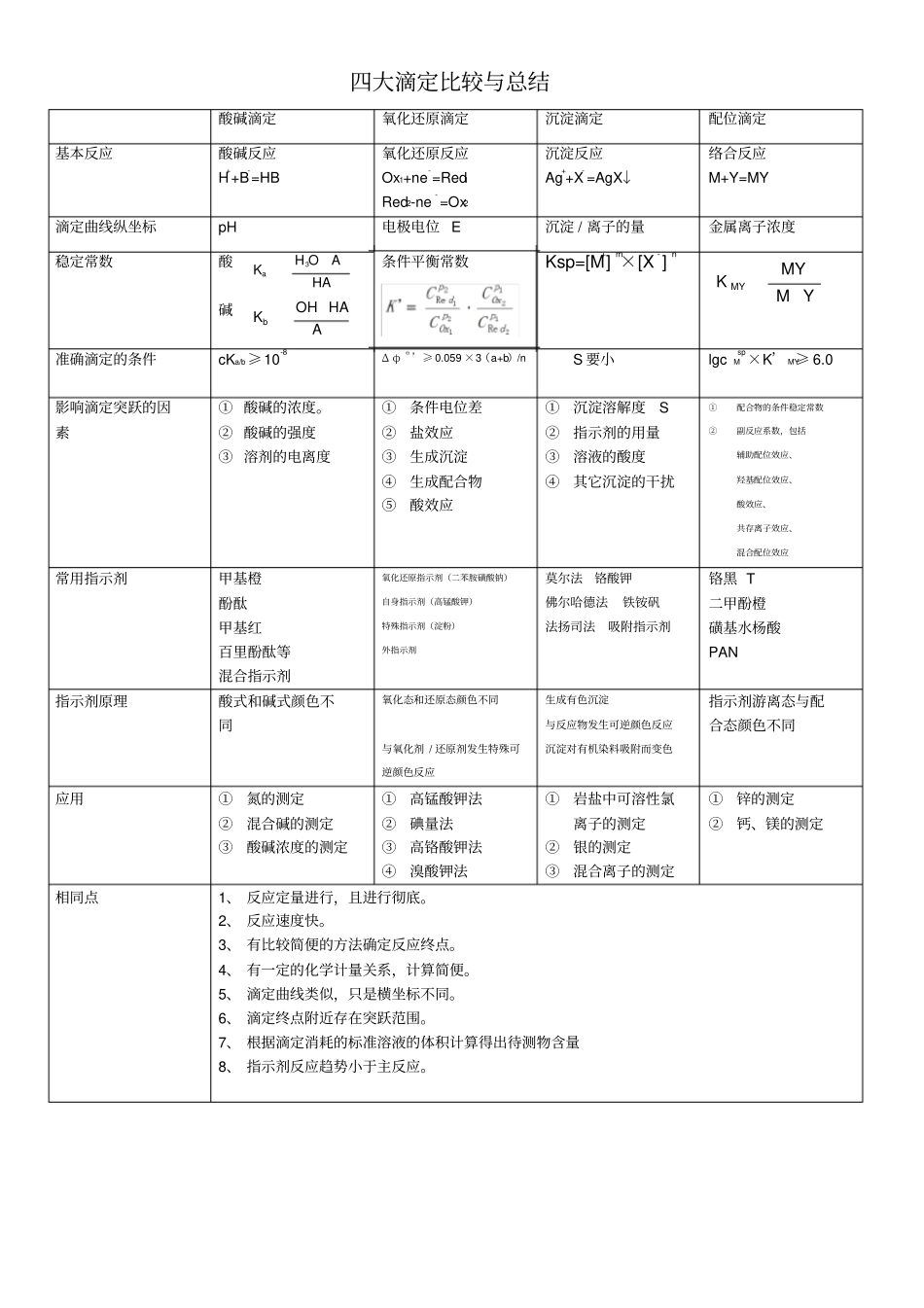
四大滴定比较与总结酸碱滴定氧化还原滴定沉淀滴定配位滴定基本反应酸碱反应H++B-=HB 氧化还原反应Ox1+ne-=Red1Red2-ne- =Ox2沉淀反应Ag++X- =AgX↓络合反应M+Y=MY 滴定曲线纵坐标pH 电极电位 E 沉淀 / 离子的量金属离子浓度稳定常数酸碱条件平衡常数Ksp=[M+]m×[X-]n准确滴定的条件cKa/b≥10-8Δ φΘ ’≥ 0.059 ×3(a+b)/nS 要小lgcMsp×K’ MY≥ 6.0 影响滴定突跃的因素① 酸碱的浓度。② 酸碱的强度③ 溶剂的电离度①条件电位差②盐效应③生成沉淀④生成配合物⑤酸效应①沉淀溶解度S ②指示剂的用量③溶液的酸度④其它沉淀的干扰①配合物的条件稳定常数②副反应系数,包括辅助配位效应、羟基配位效应、酸效应、共存离子效应、混合配位效应常用指示剂甲基橙酚酞甲基红百里酚酞等混合指示剂氧化还原指示剂(二苯胺磺酸钠)自身指示剂(高锰酸钾)特殊指示剂(淀粉)外指示剂莫尔法铬酸钾佛尔哈德法铁铵矾法扬司法吸附指示剂铬黑 T 二甲酚橙磺基水杨酸PAN 指示剂原理酸式和碱式颜色不同氧化态和还原态颜色不同与氧化剂 / 还原剂发生特殊可逆颜色反应生成有色沉淀与反应物发生可逆颜色反应沉淀对有机染料吸附而变色指示剂游离态与配合态颜色不同应用①氮的测定②混合碱的测定③酸碱浓度的测定①高锰酸钾法②碘量法③高铬酸钾法④溴酸钾法①岩盐中可溶性氯离子的测定②银的测定③混合离子的测定①锌的测定②钙、镁的测定相同点1、 反应定量进行,且进行彻底。2、 反应速度快。3、 有比较简便的方法确定反应终点。4、 有一定的化学计量关系,计算简便。5、 滴定曲线类似,只是横坐标不同。6、 滴定终点附近存在突跃范围。7、 根据滴定消耗的标准溶液的体积计算得出待测物含量8、 指示剂反应趋势小于主反应。HAAOHKa3AHAOHKbYMMYK MY