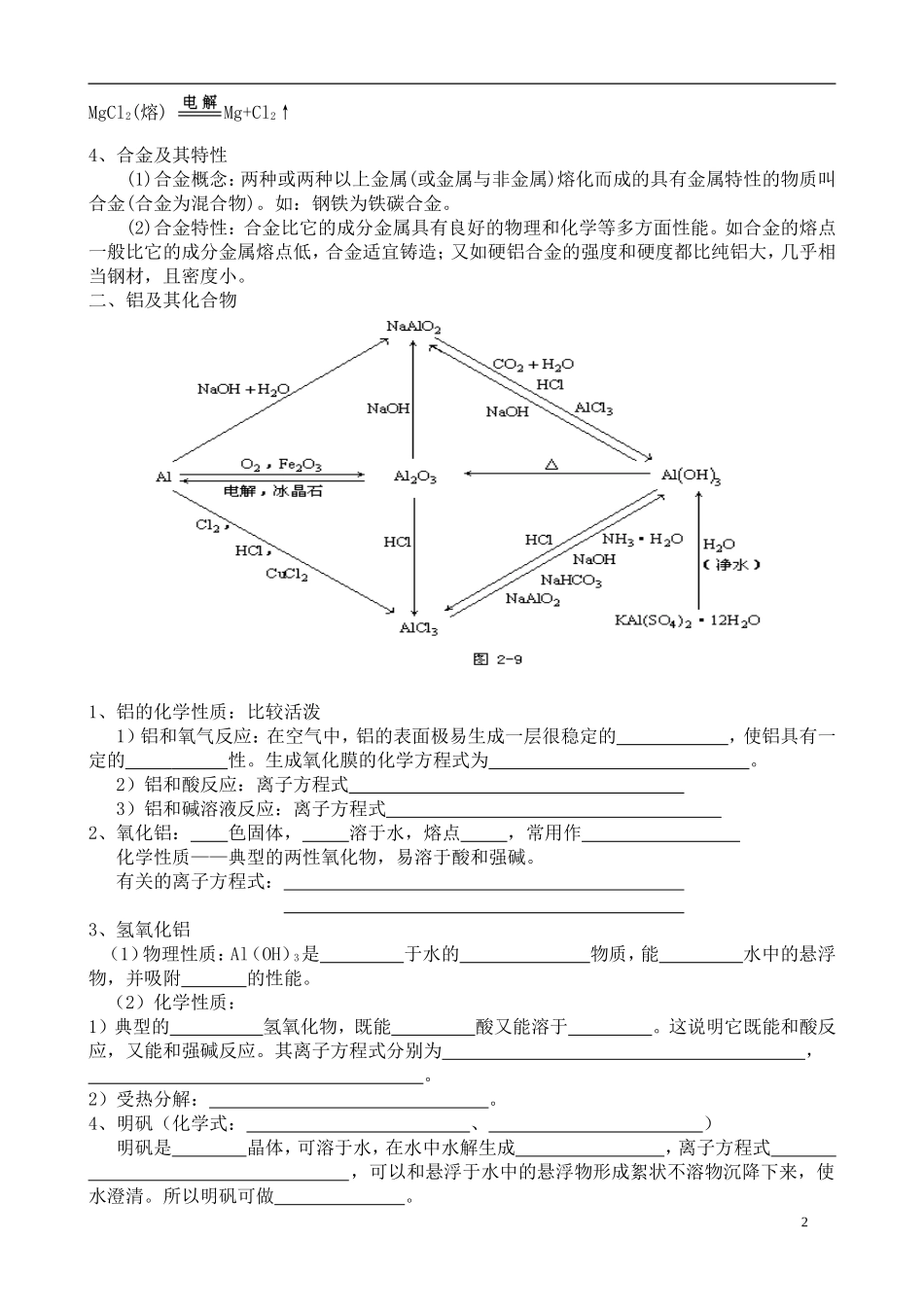
第八讲 镁和铝及其化合物※ 知识要点 一、镁及其化合物 金属的化学性质特点:1、在水溶液中,按金属失电子形成水合阳离子能力的大小,而排列出金属活动性顺序表:(1)金属与水反应:如:Mg + 2H2O = Mg(OH)2↓+ H2↑(2)金属与氧气反应:(3)金属与非氧化性酸(盐酸 稀 H2SO4)反应:① 氢前金属能置换酸中的氢,生成盐和氢气。②氢后金属不能发生反应(4)金属与氧化性酸(浓 H2SO4,浓稀 HNO3)反应,Mg→Ag 与氧化性酸发生氧化一还原反应,生成盐、水和气体,但气体不是氢气,而是含氧酸的还原产物,其中硫酸还原产物是 SO2↑,浓硝酸还原产物是 NO2↑,稀硝酸还原产物是NO↑。如: Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O3Cu+8HNO3(稀)==3Cu(NO3)2+2NO↑+4H2OCu+4HNO3(浓)==Cu(NO3)2+2NO2↑+2H2O(5)金属与盐溶液反应:(6)某些金属与氧化物反应: Mg 与 CO2发生置换反应,生成黑、白色两种粉末。2Mg+CO2 2MgO+C(8)金属与非金属(S、F2、Cl2等)反应3Mg+N2 Mg3N2.2、金属氧化物对应的水化物为碱,碱的稳定性比较:Mg 和水缓慢反应,生成难溶性碱 Mg(OH)2 ;Mg(OH)受热易分解。3、金属冶炼方法:电解法:制 K→Al,电解熔融态金属盐或氧化物。2NaCl(熔) 2Na+Cl2↑1MgCl2(熔) Mg+Cl2↑4、合金及其特性(1)合金概念:两种或两种以上金属(或金属与非金属)熔化而成的具有金属特性的物质叫合金(合金为混合物)。如:钢铁为铁碳合金。(2)合金特性:合金比它的成分金属具有良好的物理和化学等多方面性能。如合金的熔点一般比它的成分金属熔点低,合金适宜铸造;又如硬铝合金的强度和硬度都比纯铝大,几乎相当钢材,且密度小。二、铝及其化合物 1、铝的化学性质:比较活泼 1)铝和氧气反应:在空气中,铝的表面极易生成一层很稳定的 ,使铝具有一定的 性。生成氧化膜的化学方程式为 。 2)铝和酸反应:离子方程式 3)铝和碱溶液反应:离子方程式 2、氧化铝: 色固体, 溶于水,熔点 ,常用作 化学性质——典型的两性氧化物,易溶于酸和强碱。 有关的离子方程式: 3、氢氧化铝 (1)物理性质:Al(OH)3是 于水的 物质,能 水中的悬浮物,并吸附 的性能。 (2)化学性质:1)典型的 氢氧化物,既能 酸又能溶于 。这说明它既能和酸反应,又能和强碱反应。其离子方程式分别为 , 。2)受热分解: 。4、明矾(化学式: 、 ) 明矾是 晶体,可溶于水,在水中水解生成 ,离子方程式 ,可以和悬浮于水中...