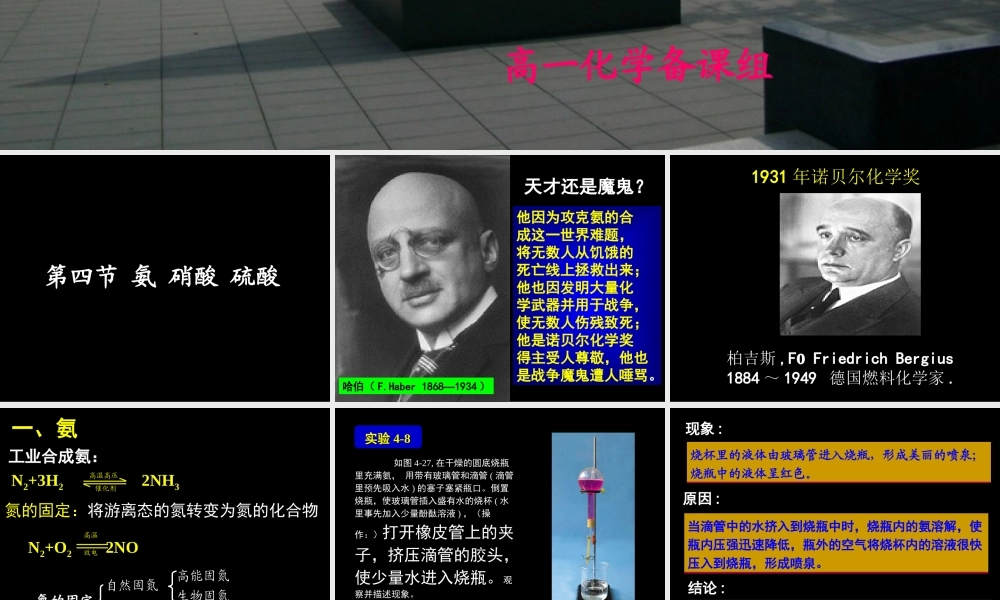
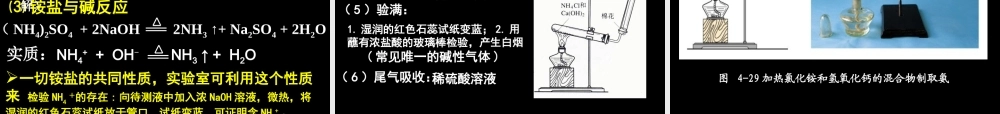
新课标高一化学课件高一化学备课组第四节 氨 硝酸 硫酸天才还是魔鬼?哈伯( F.Haber 1868—1934 )他因为攻克氨的合成这一世界难题,将无数人从饥饿的死亡线上拯救出来;他也因发明大量化学武器并用于战争,使无数人伤残致死;他是诺贝尔化学奖得主受人尊敬,他也是战争魔鬼遭人唾骂。1931 年诺贝尔化学奖柏吉斯 ,F Friedrich Bergius 1884 ~ 1949 德国燃料化学家 .一、氨工业合成氨:氮的固定:将游离态的氮转变为氮的化合物 N2+3H2 2NH3高温高压催化剂N2+O2 2NO高温放电人工固氮生物固氮高能固氮自然固氮氮的固定 如图 4-27, 在干燥的圆底烧瓶里充满氨, 用带有玻璃管和滴管 ( 滴管里预先吸入水 ) 的塞子塞紧瓶口。倒置烧瓶,使玻璃管插入盛有水的烧杯 ( 水里事先加入少量酚酞溶液 ) ,(操作:)打开橡皮管上的夹子,挤压滴管的胶头,使少量水进入烧瓶。观察并描述现象。实验实验 4-84-8图 4-27 氨溶于水的喷泉实验现象 :烧杯里的液体由玻璃管进入烧瓶,形成美丽的喷泉;烧瓶中的液体呈红色。原因 :结论 :① 氨气极易溶于水 (1:700) 。使烧瓶内气压急剧下降。② 氨气水溶液呈碱性。当滴管中的水挤入到烧瓶中时,烧瓶内的氨溶解,使瓶内压强迅速降低,瓶外的空气将烧杯内的溶液很快压入到烧瓶,形成喷泉。城市中常见的人造喷泉及火山爆发的原理与上述的原理相似。科学视野 ( 1 )实验成败的关键是什么? 想想看:a. 烧瓶干燥;b. 装置的气密性好;c. 收集的气体纯度尽可能高。(2) 喷泉停止后,为什么烧瓶不能被水完全充满? 由于氨气是用向下排空气法收集的,一定 含有少量空气。( 3 )常见能形成喷泉物质组合: NH3 + 水或盐酸;HCl+ 水或 NaOH 溶液; SO2(CO2)+ 浓 NaOH ; NO2+O2+ 水:思考与练习 在氨的喷泉实验中,烧瓶内溶液的物质的量浓度是多少?(假设实验是在标准状况下进行) 氨气体积设为 VL 氨气物质的量为 (V/22.4)mol 氨水溶液体积也是 VL 氨水溶液物质的量浓度为 (V/22.4)/V= 0.045 mol/L1. 氨的性质⑴ 物理性质① 色、味、态:② 密度:③ 溶解性:④ 沸点:无色、刺激性气味比空气轻极易溶于水( 1 : 700 )-33.5℃ ,易液化(液氨可做制冷剂) (1)NH3 与水的反应NH4+ + OH- NH3 + H2O NH3·H2O思考:如果用湿润的红色石蕊试纸接触氨,会发生什么变化?为什么?红色石蕊试纸变蓝。因氨气溶于水形成氨水,氨水显弱碱性...