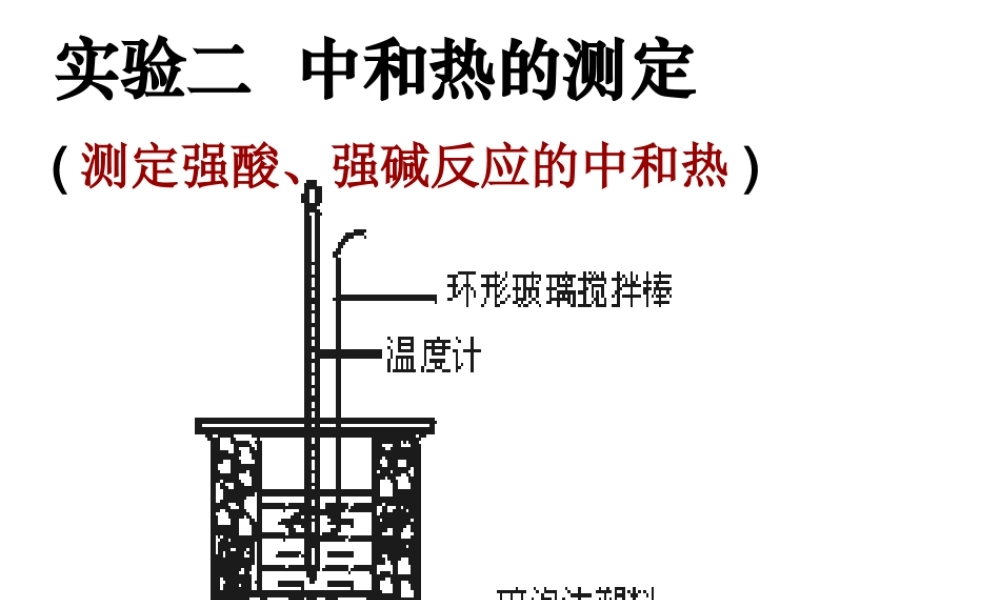
实验二 中和热的测定 ( 测定强酸、强碱反应的中和热 ) 主讲:吉登发 实验原理: 50 mL (大约 50g ) 0.50 mol/L 的盐酸与 50mL (大约 50g ) 0.55 mol/L 氢氧化钠 设 t1: 反应前两溶液的平均温度。 t2: 反应后溶液温度 c=4.18 J/ ( g·℃ )试求 Q 放的表达式和中和热表达式 Q=mc(t2 - t1) =0.418 ( t2 - t1 ) kJΔH= - 0.418 ( t2 - t1 )0.025kJ/mol 实验步骤:1. 保温。在大烧杯底部垫泡沫塑料,使放入的小烧杯杯口与大烧杯杯口相平。然后再在大、小烧杯之间填满碎泡沫塑料,大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过,如图所示。 答案: . 两杯口相平,可使盖板把杯口尽量盖严,从而减少热量损失;填碎纸条的作用是为了达到保温隔热、减少实验过程中热量损失的目的。若换用隔热、密封性能更好的装置(如保温杯)会使实验结果更准确。思考:大、小烧杯放置时,为何要使两杯口相平?填碎纸条的作用是什么?对此装置,你有何更好的建议? 2. 用一个量筒最取 50 mL 0.50 mol/L 盐酸,倒入小烧杯中,并用温度计测量盐酸的温度,记入下表。然后把温度计上的酸用水冲洗干净。思考:温度计上的酸为何要用水冲洗干净?冲洗后的溶液能否倒入小烧杯?为什么? 答:因为该温度计还要用来测碱液的温度,若不冲洗,温度计上的酸会和碱发生中和反应而使热量散失,故要冲洗干净;冲洗后的溶液不能倒入小烧杯,若倒入,会使总溶液的质量增加,而导致实验结果误差。 3. 用另一个量筒量取 50 mL 0.55 mol/L NaOH 溶液,并用温度计测量 NaOH 溶液的温度,记入下表。4. 把温度计和环形玻璃搅拌棒放入小烧杯的盐酸中,并把量筒中的 NaOH 溶液一次倒入小烧杯(注意不要洒到外面)。用环形玻璃搅拌棒轻轻搅动溶液,并准确读取混合溶液的最高温度,记为终止温度,记入下表。 思考:酸、碱混合时,为何要把量筒中的NaOH 溶液一次倒入小烧杯而不能缓缓倒入?答:因为本实验的关键是测反应的反应热,若动作迟缓,将会使热量损失而使误差增大。思考:实验中所用 HCl 和 NaOH 的物质的量比为何不是 1∶1 而是 NaOH 过量?若用 HCl 过量行吗? 答:为了保证 0.50 mol/L 的盐酸完全被 NaOH 中和,采用 0.55 mol/L NaOH 溶液,使碱稍稍过量。若使盐酸过量,亦可。5. 重复实验两次,取测量所得数据的平均值...