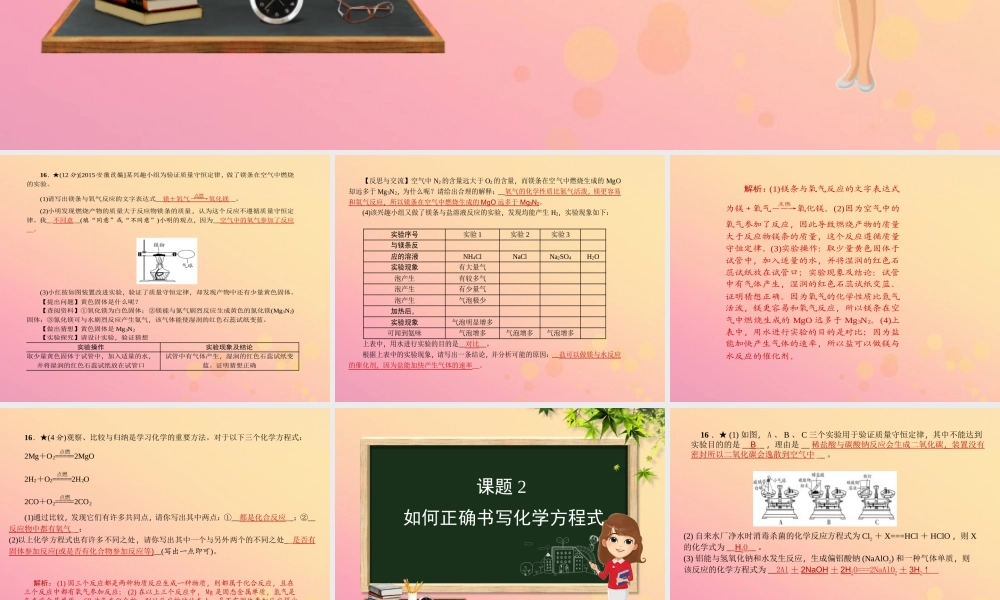
第五单元 化学方程式课题 1 质量守恒定律16.★(12 分)[2015·安徽改编]某兴趣小组为验证质量守恒定律,做了镁条在空气中燃烧的实验。(1)请写出镁条与氧气反应的文字表达式__镁+氧气――→点燃 氧化镁__。(2)小明发现燃烧产物的质量大于反应物镁条的质量,认为这个反应不遵循质量守恒定律。我__不同意__(填“同意”或“不同意”)小明的观点,因为__空气中的氧气参加了反应__。(3)小红按如图装置改进实验,验证了质量守恒定律,却发现产物中还有少量黄色固体。【提出问题】黄色固体是什么呢?【查阅资料】①氧化镁为白色固体;②镁能与氮气剧烈反应生成黄色的氮化镁(Mg3N2)固体;③氮化镁可与水剧烈反应产生氨气,该气体能使湿润的红色石蕊试纸变蓝。【做出猜想】黄色固体是 Mg3N2【实验探究】请设计实验,验证猜想实验操作实验现象及结论取少量黄色固体于试管中,加入适量的水,并将湿润的红色石蕊试纸放在试管口试管中有气体产生,湿润的红色石蕊试纸变蓝。证明猜想正确【反思与交流】空气中 N2 的含量远大于 O2 的含量,而镁条在空气中燃烧生成的 MgO却远多于 Mg3N2,为什么呢?请给出合理的解释:__氧气的化学性质比氮气活泼,镁更容易和氧气反应,所以镁条在空气中燃烧生成的 MgO 远多于 Mg3N2。(4)该兴趣小组又做了镁条与盐溶液反应的实验,发现均能产生 H2,实验现象如下:实验序号实验 1实验 2实验 3与镁条反应的溶液NH4ClNaClNa2SO4H2O实验现象有大量气泡产生有较多气泡产生有少量气泡产生气泡极少加热后,实验现象气泡明显增多可闻到氨味气泡增多气泡增多气泡增多上表中,用水进行实验的目的是__对比__。根据上表中的实验现象,请写出一条结论,并分析可能的原因:__盐可以做镁与水反应的催化剂,因为盐能加快产生气体的速率__。解析:(1)镁条与氧气反应的文字表达式为镁+氧气――→点燃 氧化镁。(2)因为空气中的氧气参加了反应,因此导致燃烧产物的质量大于反应物镁条的质量,这个反应遵循质量守恒定律。(3)实验操作:取少量黄色固体于试管中,加入适量的水,并将湿润的红色石蕊试纸放在试管口;实验现象及结论:试管中有气体产生,湿润的红色石蕊试纸变蓝。证明猜想正确。因为氧气的化学性质比氮气活泼,镁更容易和氧气反应,所以镁条在空气中燃烧生成的 MgO 远多于 Mg3N2。(4)上表中,用水进行实验的目的是对比;因为盐能加快产生气体的速率,所以盐可以做镁与水反应的催化剂。16.★(4 分)观察、比较与归纳...