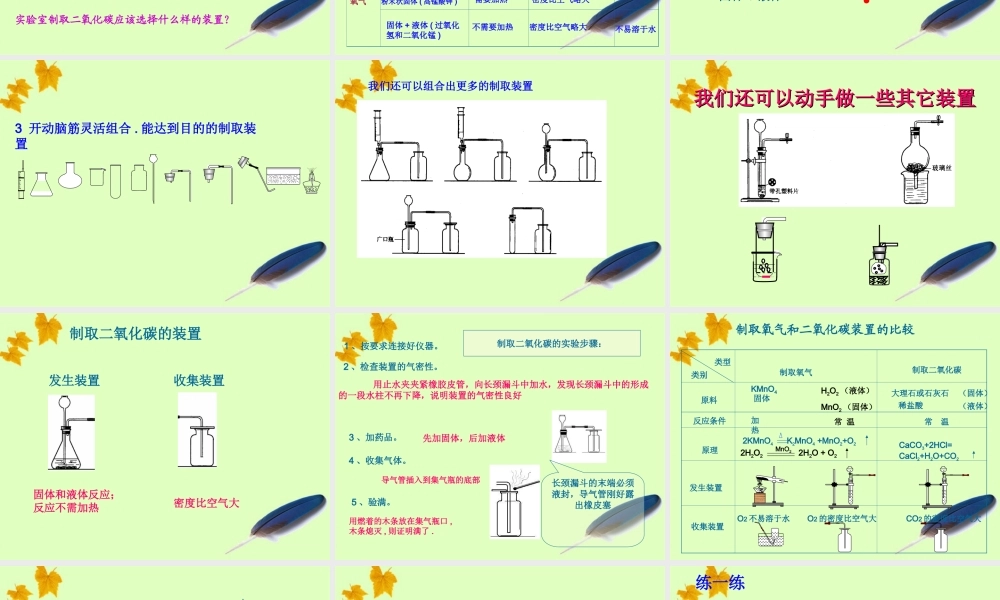
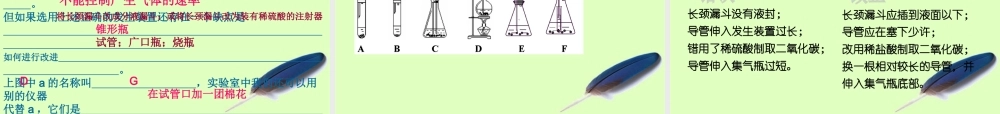
二氧化碳制取的研究5.2 第 5 课时能生成二氧化碳的反应有哪些?④ 碱式碳酸铜受热分解;① 木炭燃烧; C + O2 === CO2点燃③ 碳酸分解; H2CO3 === H2O + CO2Cu2(OH)2CO3 === 2CuO + H2O + CO2⑤ 木炭还原氧化铜; C + 2CuO === 2Cu + CO2高温制取的 CO2 气体含 O2 ,不易除去碳酸的量 太少反应条件 太高 不易除去 水蒸汽②CO 燃烧: 2CO + O2 === 2CO2点燃制取的 CO2 气体含 O2 或 CO ,不易除去实验室里制取二氧化碳的研究一、 初步研究制取二氧化碳的反应原理即化学方程式可以采用。2 、稀硫酸与大理石(或石灰石)反应原理: H2SO4 +CaCO3 ==CaSO4 + CO2 + H2O 结论:3 、稀盐酸和大理石(或石灰石)反应原理: CaCO3 +2HCl ==CaCl2 +CO2 ↑ + H2O 结论:1 、稀盐酸与碳酸钠反应原理: Na2CO3 +2HCl ==2NaCl + CO2 + H2O 结论: 速度太快,来不及收集,不宜采用。生成微溶的 CaSO4 ,覆盖在大理石或石灰石表面, 阻止反应继续进行,不宜采用。也不能用 CaCO3 粉末代替大理石或者石灰石 , 也因为反应速度太快 , 很难控制 .药品:稀盐酸和大理石(或石灰石, 主要成分是 CaCO3 )原理: CaCO3 +2HCl ==CaCl2 +CO2 ↑ + H2O 盐酸是氯化氢的水溶液,易挥发出氯化氢 HCl 气体,且浓度越大,挥发性越强。为什么不能用浓盐酸来制取二氧化碳?碳酸钙是一种难溶于水的白色固体。实验室制取二氧化碳应该选择什么样的装置?④ 不用 Na2CO3 或 NaHCO3, 因为反应太快,不易 控制,不便操作。③ 不用浓盐酸,因为浓盐酸具有较强的挥发性, 使制得的二氧化碳中混有大量的氯化氢气体。② 不用稀硫酸,是因为生成的 CaSO4 微溶于水, 覆盖在大理石的表面,阻碍反应的继续进行。① 用此法制得的二氧化碳气体中混有极少量的氯 化氢气体和水蒸气。注意:注意:反应物的状态反应条件 气体密度与空气大小比较溶解性二氧化碳氧气块状固体 ( 大理石或石灰石 ) 和液体的( 稀盐酸 )不需要加热密度比空气大能溶于水粉末状固体 ( 高锰酸钾 )需要加热密度比空气略大不易溶于水固体 + 液体 ( 过氧化氢和二氧化锰 )不需要加热密度比空气略大不易溶于水二 . 探究实验室里制取二氧化碳的装置1. 制取气体装置包括 和 两部分发生装置收集装置气体发生装置 :反应物状态反应条件气体收集方法 :排空气法2. 二氧化碳和氧气制取实验及相...