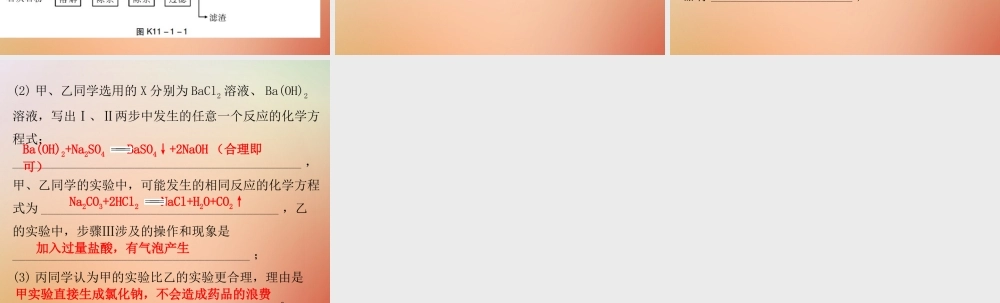
课堂小测本 第十一单元盐化肥课题 1 生活中常见的盐课时 2 盐的化学性质复分解反应A1. (3 分 ) 下列物质既能和盐酸反应,又能和熟石灰反应的是( )A. Na2CO3 B. CuOC. FeCl3 D. KNO32. (3 分 ) 不能鉴别 Na2CO3 与 NaCl 的物质是( )A. Ca(OH)2 B. HClC. NaOH D. 酚酞3. (3 分 ) 只用一种试剂就能鉴别稀盐酸、氯化钠、氢氧化钠三种溶液,这种试剂是 ( )A. 紫色石蕊溶液B. KNO3 溶液C. BaCl2 溶液 D. Na2CO3 溶液CA4. (3 分 ) 要除去氯化钠溶液中混有少量的碳酸钠,可加入适量的( )A. 石灰水B. 氯化钾溶液C. 盐酸D. 硝酸银溶液5. (3 分 ) 下列物质在水溶液中能大量共存的是( )A. NaCl 、 Na2CO3 、 H2SO4B. FeCl3 、 Na2SO4 、 KOHC. BaCl2 、 AgNO3 、 Na2CO3D. CuSO4 、 KNO3 、 Na2SO4CD6. (3 分 ) 下列各组物质相互间不能发生复分解反应的是( )A. NaOH 、 HClB. BaCl2 、 Na2CO3C. NaCl 、 Na2SO4D. CuSO4 、 KOHC7. (6 分 ) 氯化钙在生活中常用作干燥剂、融雪剂,在工业上可用于制造防冻液等。某工厂以石灰石为原料生产二水氯化钙 (CaCl2·2H2O) 的流程如图 K11-1-1 所示。原料石灰石中含有的杂质主要是 MgCO3 、 MgSO4 和 Al2O3 。(1) 石灰石粉溶解时, Al2O3 发生反应的化学方程式为________________________________ ;(2) 加入 BaCl2 除去的杂质离子是____________________ ;(3) 检验“滤液”酸碱性,如果显碱性,还需加入适量的 ______ ( 填化学式 ) 提高产品纯度。Al2O3+6HCl 2AlCl3+3H2OHCl硫酸根离子(或 SO2- )48. (6 分 ) 除去 NaCl 中混有的少量 Na2SO4 ,某探究小组设计了如图 K11-1-2 所示方案进行实验:(1)Ⅰ 、Ⅱ两步都有过滤操作,过滤中要用到的玻璃仪器有 ______________________ ;漏斗、烧杯和玻璃棒(2) 甲、乙同学选用的 X 分别为 BaCl2 溶液、 Ba(OH)2溶液,写出Ⅰ、Ⅱ两步中发生的任意一个反应的化学方程式:_____________________________________________ ,甲、乙同学的实验中,可能发生的相同反应的化学方程式为 _____________________________________ ,乙的实验中,步骤Ⅲ涉及的操作和现象是_____________________________________ ;(3) 丙同学认为甲的实验比乙的实验更合理,理由是_________________________________________ 。甲实验直接生成氯化钠,不会造成药品的浪费Ba(OH)2+Na2SO4 BaSO4↓+2NaOH (合理即可)Na2CO3+2HCl2 NaCl+H2O+CO2↑加入过量盐酸,有气泡产生