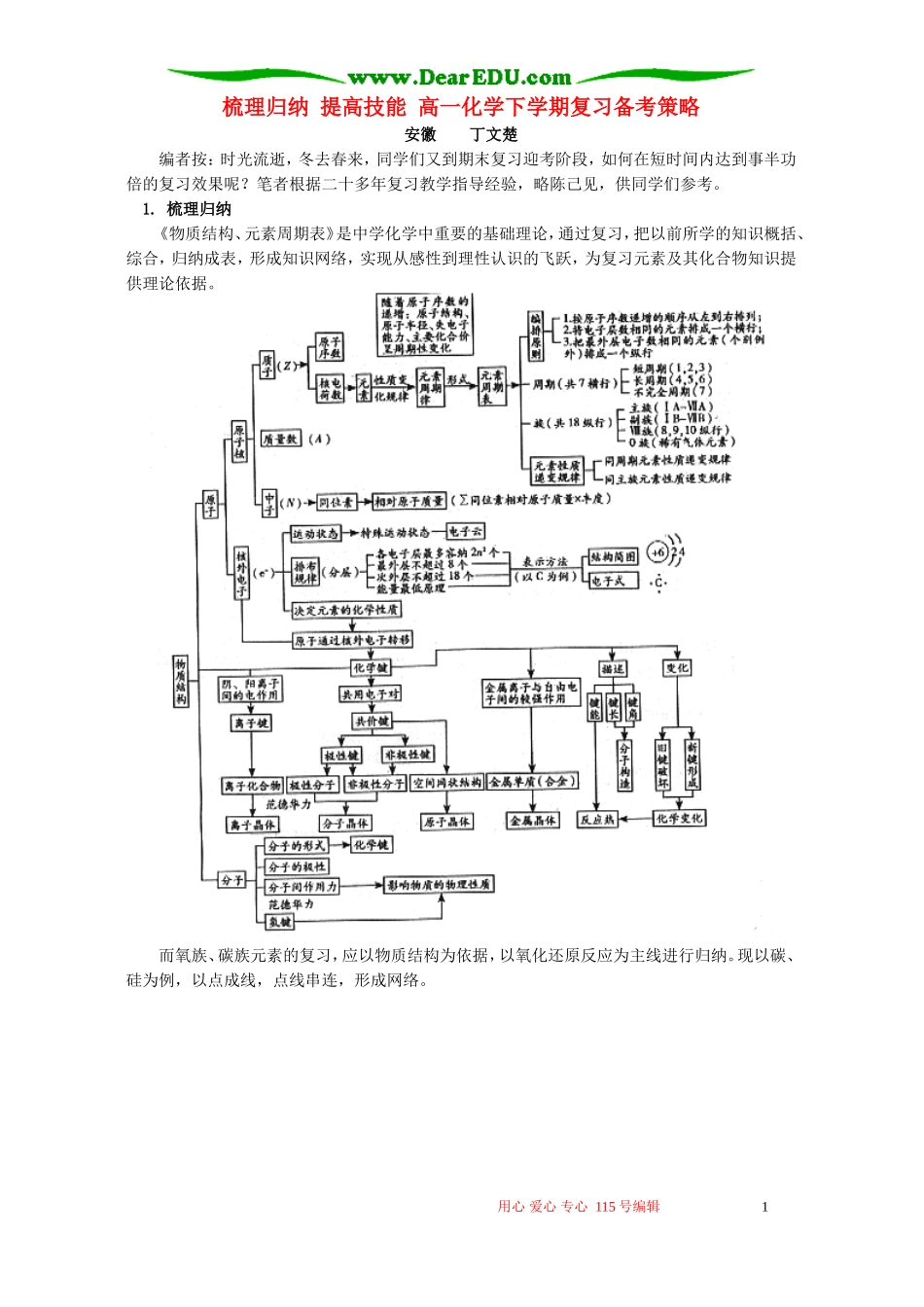
梳理归纳 提高技能 高一化学下学期复习备考策略安徽丁文楚编者按:时光流逝,冬去春来,同学们又到期末复习迎考阶段,如何在短时间内达到事半功倍的复习效果呢?笔者根据二十多年复习教学指导经验,略陈己见,供同学们参考。 1. 梳理归纳《物质结构、元素周期表》是中学化学中重要的基础理论,通过复习,把以前所学的知识概括、综合,归纳成表,形成知识网络,实现从感性到理性认识的飞跃,为复习元素及其化合物知识提供理论依据。而氧族、碳族元素的复习,应以物质结构为依据,以氧化还原反应为主线进行归纳。现以碳、硅为例,以点成线,点线串连,形成网络。用心 爱心 专心 115 号编辑 1 2. 突出重点用位构性的观点,全面、系统、科学地突出重点。如硫及其重要化合物。(1)的变化规律:溶液中被氧化为 即氢硫酸或可溶性硫化物与、氯水、溴水、碘水发生反应时,一般置换出单质硫。(2) 的变化规律: 既有氧化性又有还原性,遇较强还原剂时常作氧化剂,若金属有可变化合价,由于硫的氧化性不太强,所以形成低价硫化物。但特殊的反应是:Hg+S=HgS。若硫作还原剂时,一般地遇强氧化剂时硫被氧化成,如 S+6HNO3(浓)=H2SO4+2H2O+6NO2↑,或者硫被氧化成, 如, 但 硫 由 于 位 于 中 间 价 态 , 所 以 还 能 发 生 歧 化 反 应 , 即 :。(3)的变化规律:处于中间价态,故既有氧化性又有还原性。遇强氧化剂如O2、Cl2、Br2、I 2 等反应时,。遇强还原剂时,。如:SO2+2Mg.(4) 的变化规律: 处于最高价态,只具有氧化性,热的浓遇到较强还原性的物质均可反应,一般被还原成。如:+SO2↑+4HCl+2H2O。碳族元素的原子核外都有 4 个电子,属 IVA 族,在周期表中可谓“承前启后”。已学过 IA、IIA 族是典型的金属元素,VA、VIA、VIIA 族则主要学习元素的非金属性质,IIIA族只学习铝,而碳族元素位于金属与非金属的“交界”处,因而其化学性质均不太活泼。C、Si 属不太活泼的非金属,Ge、Sn、Pb 属不太活泼的金属,Si、Ge 均即有金属性又有非金属性,成键特征——共价键。碳族元素较明显地表现出同族元素由非金属向金属过渡的特点。从碳到铅,元素的非金属性减弱而金属性增强,单质及其化合物的性质也明显地呈现出一定的递变规律。应沿着原子结构→元素性质递变规律→单质的结构和性质→化合物(氧化物、酸及其盐)的性质和用途这一线索去认识、总结。 3. 注意特例在总结知识规律的...