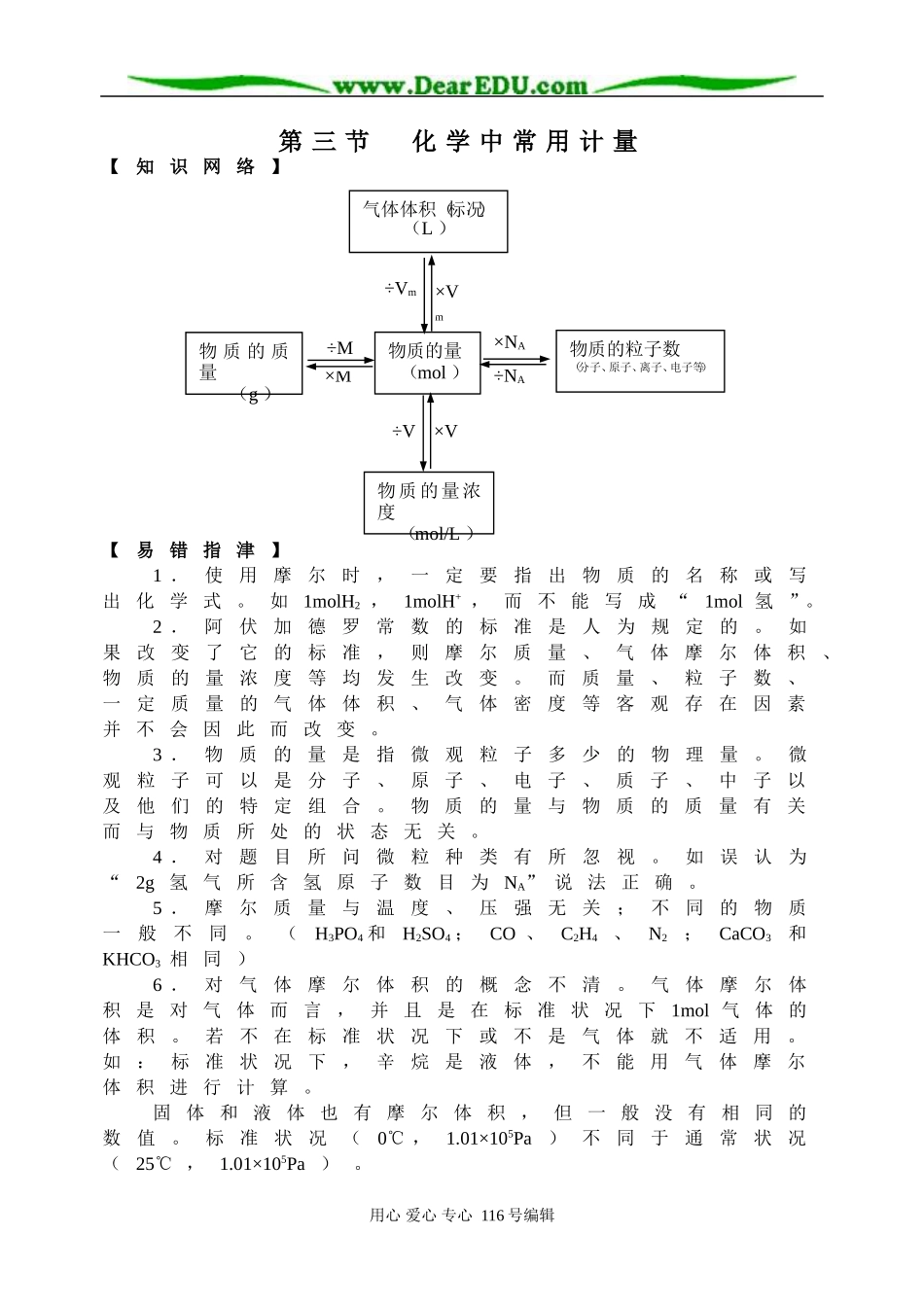
第 三 节 化 学 中 常 用 计 量【知 识 网 络】【易 错 指 津】1 .使用摩尔时,一定要指出物质的名称或写出 化 学 式 。 如1molH2 , 1molH+ , 而 不 能 写 成 “1mol 氢 ”。2 .阿伏加德罗常数的标准是人为规定的。如果改变了它的标准,则摩尔质量、气体摩尔体积、物质的量浓度等均发生改变。而质量、粒子数、一定质量的气体体积、气体密度等客观存在因素并 不 会 因 此 而 改 变 。3 .物质的量是指微观粒子多少的物理量。微观粒子可以是分子、原子、电子、质子、中子以及他们的特定组合。物质的量与物质的质量有关而 与 物 质 所 处 的 状 态 无 关 。4 .对题目所问微粒种类有所忽视。如误认为“2g 氢 气 所 含 氢 原 子 数 目 为NA” 说 法 正 确 。5 .摩尔质量与温度、压强无关;不同的物质一般不同。(H3PO4 和H2SO4 ;CO 、C2H4、N2;CaCO3和KHCO3 相 同 )6 .对气体摩尔体积的概念不清。气体摩尔体积 是 对 气 体 而 言 , 并 且 是 在 标 准 状 况 下1mol 气 体 的体积。若不在标准状况下或不是气体就不适用。如:标准状况下,辛烷是液体,不能用气体摩尔体 积 进 行 计 算 。固 体 和 液 体 也 有 摩 尔 体 积 , 但 一 般 没 有 相 同 的数值。标准状况(0℃ ,1.01×105Pa)不同于通常状况(25℃ ,1.01×105Pa ) 。用心 爱心 专心 116 号编辑×Vm÷Vm÷NA×NA×M÷M×V÷V物质的量 (mol )物 质 的 质量 (g )物质的粒子数(分子、原子、离子、电子等)气体体积(标况) (L )物 质 的量浓度 (mol/L )7 .物质的量的大小,可衡定物质所含微粒的多少,但物质的量的数值并不是微粒的个数,它的 个 数 应 该 是 物 质 的 量 乘 以6.02×1023mol-` 。8 .气体摩尔体积使用的条件是:前提——标准状况;是指气体本身的状况,而不是外界条件的 状 况 , 因 此 就 不 能 说 “1mol 水 蒸 气 在 标 准 状 况 下所占的体积是22.4L”。研究对象是——气体(包括混合气体),但概念中的“任何气体”却不包括一些易挥发性物质的蒸气,如水蒸气、溴蒸气、碘蒸气等。量的标准是——1mol ,结论——约是22.4L ,此外还应注意:并非只有标准状况下,1mol气 体 的 体 积 才 约 是22.4L 。9. 外界温度和压强影响气体体积的大小,但气体 的...