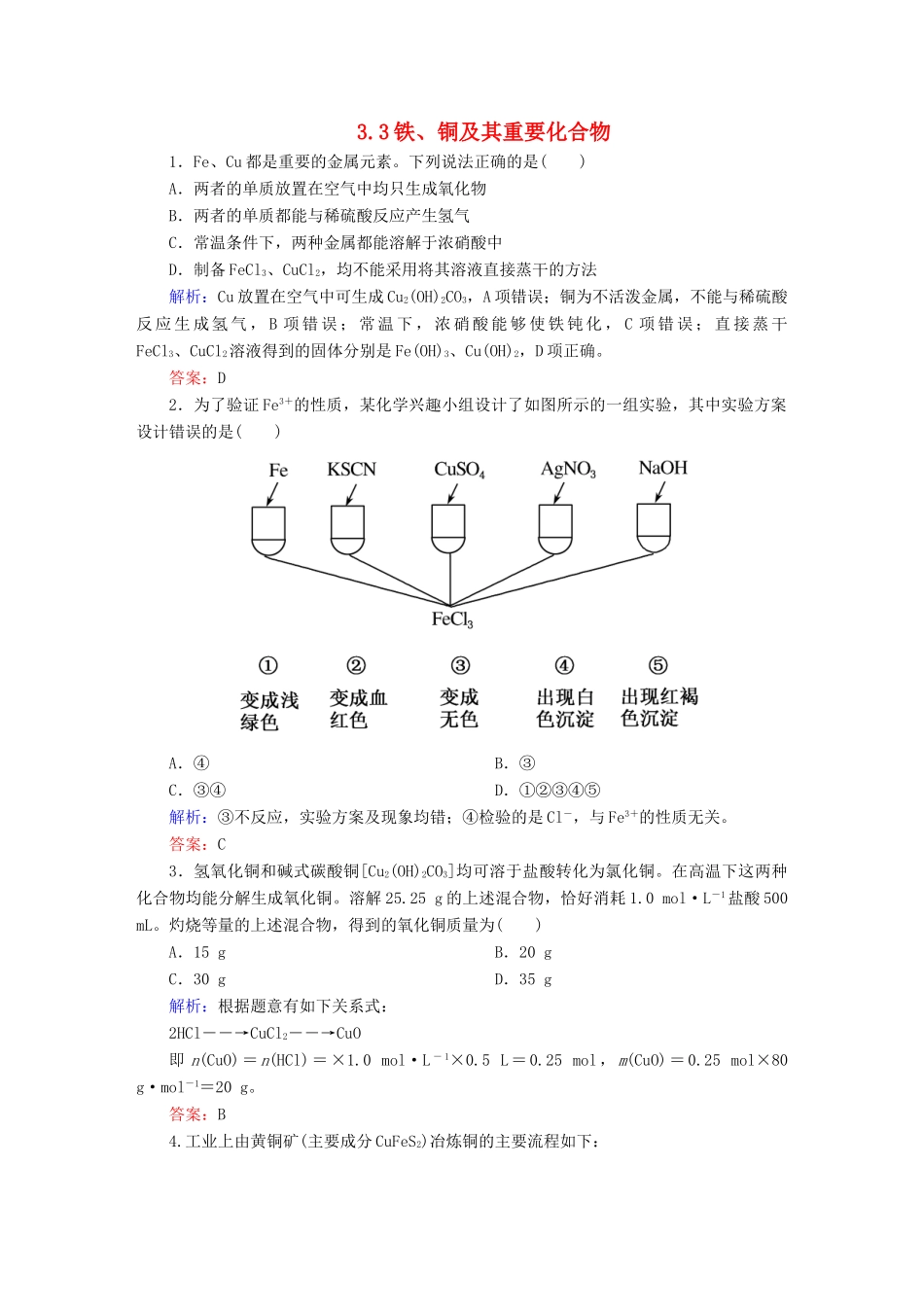
3.3 铁、铜及其重要化合物1.Fe、Cu 都是重要的金属元素。下列说法正确的是( )A.两者的单质放置在空气中均只生成氧化物B.两者的单质都能与稀硫酸反应产生氢气C.常温条件下,两种金属都能溶解于浓硝酸中D.制备 FeCl3、CuCl2,均不能采用将其溶液直接蒸干的方法解析:Cu 放置在空气中可生成 Cu2(OH)2CO3,A 项错误;铜为不活泼金属,不能与稀硫酸反 应 生 成 氢 气 , B 项 错 误 ; 常 温 下 , 浓 硝 酸 能 够 使 铁 钝 化 , C 项 错 误 ; 直 接 蒸 干FeCl3、CuCl2溶液得到的固体分别是 Fe(OH)3、Cu(OH)2,D 项正确。答案:D2.为了验证 Fe3+的性质,某化学兴趣小组设计了如图所示的一组实验,其中实验方案设计错误的是( )A.④ B.③C.③④ D.①②③④⑤解析:③不反应,实验方案及现象均错;④检验的是 Cl-,与 Fe3+的性质无关。答案:C3.氢氧化铜和碱式碳酸铜[Cu2(OH)2CO3]均可溶于盐酸转化为氯化铜。在高温下这两种化合物均能分解生成氧化铜。溶解 25.25 g 的上述混合物,恰好消耗 1.0 mol·L-1盐酸 500 mL。灼烧等量的上述混合物,得到的氧化铜质量为( )A.15 g B.20 gC.30 g D.35 g解析:根据题意有如下关系式:2HCl――→CuCl2――→CuO即 n(CuO)=n(HCl)=×1.0 mol·L - 1×0.5 L=0.25 mol,m(CuO)=0.25 mol×80 g·mol-1=20 g。答案:B4.工业上由黄铜矿(主要成分 CuFeS2)冶炼铜的主要流程如下:(1)气体 A 中的大气污染物可选用下列试剂中的______吸收。a.浓 H2SO4 b.稀 HNO3c.NaOH 溶液 d.氨水(2)用稀 H2SO4浸泡熔渣 B,取少量所得溶液,滴加 KSCN 溶液后呈红色,说明溶液中存在________(填离子符号),检验溶液中还存在 Fe2+的方法是________________________________(注明试剂、现象)。(3)由泡铜冶炼粗铜的化学反应方程式为___________________ _____________________________________________________。解析:(1)气体 A 中的大气污染物为 SO2,可以用 NaOH 溶液、氨水吸收。(2)滴加 KSCN溶液后呈红色,说明溶液中有 Fe3+,检验溶液中还存在 Fe2+时,可以利用 Fe2+的还原性,加入酸性 KMnO4溶液,溶液紫色褪色。(3)图示中是利用铝热反应由泡铜冶炼粗铜的。答案:(1)cd(2)Fe3+ 取少量溶液,滴加酸性 KMnO4溶液,酸性 KMnO4溶液褪色(3)3Cu2O+2Al=====Al2O3+6Cu5.如图所示,此装置可用来制取和观察...