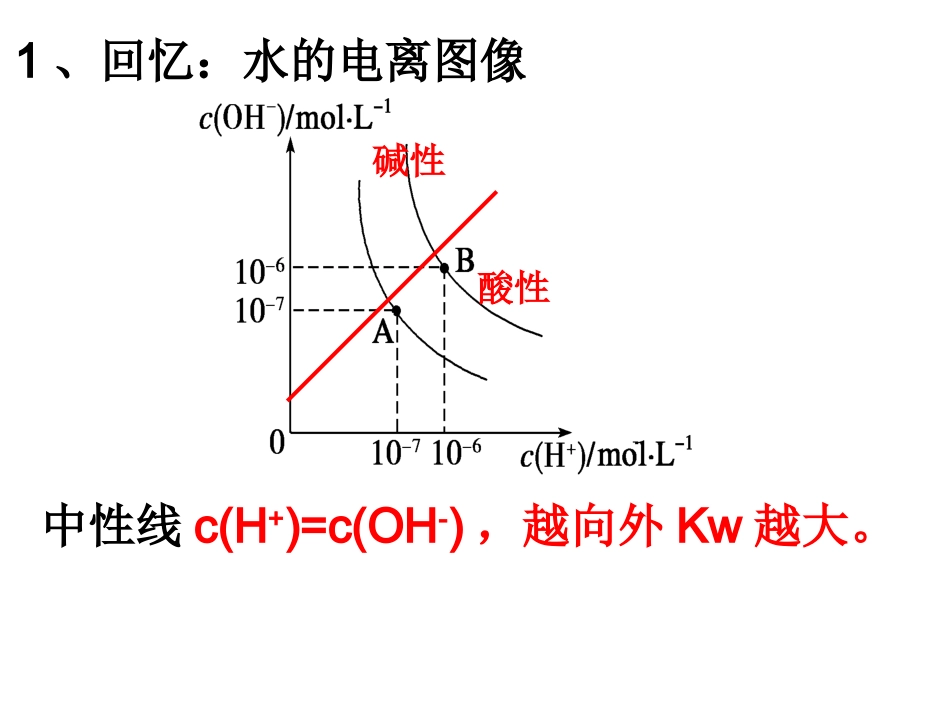
溶解平衡图像中性线c(H+)=c(OH-),越向外Kw越大。酸性碱性1、回忆:水的电离图像25°100°2、pH=-lgc(H+);pOH=-lgc(OH-);pKw=-lgKw即:pKw=-lgKw=-lgc(H+)·c(OH-)=pH+pOH3、类比,已知:BaSO4溶液的沉淀溶解平衡曲线如图所示lgc(Ba2+)-lgc(SO42-)lgc(Ba2+)lgc(SO42-)图像分析方法:1.先看横纵坐标的含义,注意有无数量级2.看曲线的走势3.注意点:起点、拐点、交点、平衡点阅读课本完成课后习题1、已知:pAg=-lg{c(Ag+)},Ksp(AgCl)=1×10-12。图3是向10mLAgNO3溶液中逐渐加入0.1mol·L-1的NaCl溶液时,溶液的pAg随着加入NaCl溶液的体积(单位mL)变化的图像(实线)。思考下列不正确的是:①原AgNO3溶液的物质的量浓度为1mol·L-1②图中x点的坐标为(100,6)③图中x点表示溶液中Ag+被完全沉淀④把0.1mol·L-1的NaCl换成0.1mol·L-1NaI则图像在终点后变为虚线部分⑤把NaCl浓度改为0.05mol·L-1则X点(向左、向右、不)移动1、SrSO4(s)+CO32-SrCO3(s)+SO42-对于上述反应,实验证明增大CO的浓度或降低温度都有利于提高SrSO4的转化率。判断在下列两种情况下,平衡常数K的变化情况(填“增大”“减小”或“不变”)。①升高温度,平衡常数K将?减小②增大CO的浓度,平衡常数K将?不变(3)已知,SrSO4和SrCO3在酸中的溶解度与BaSO4和BaCO3类似,设计实验证明上述过程中SrSO4是否完全转化成SrCO3。实验所用的试剂为________;实验现象及其相应结论为?盐酸若沉淀完全溶解,则证明SrSO4完全转化成SrCO3,否则,未完全转化2、25℃时Ksp(FeS)=6.3×10-18,Ksp(CuS)=6.3×10-36,Ksp(MnS)=2.5×10-13,常温下三种物质在水中的沉淀溶解平衡线如图所示(X表示Fe、Cu、Mn)。①曲线ⅠⅡⅢ分别代表哪种物质的溶解平衡曲线MnSFeSCuS②判断正误:向含有XS固体的d点溶液中滴加稀硫酸至过量可使固体逐渐溶解③加入稀盐酸,哪种沉淀先溶解?×MnS3、25℃时:Ksp(AgCl)=1.8×10−10,Ksp(Ag2CrO4)=9.0×10−12,Ksp(AgBr)=5.0×10−13,则AgCl和AgBr共存的悬浊液中,c(Cl−)/c(Br−)=0.36×103追问:①判断AgCl和Ag2CrO4共存的悬浊液中,c(Cl−)/c(CrO42−)=1.8×10−10/9.0×10−12×②AgCl+CrO42−===Ag2CrO4+2Cl−则其平衡常数K的表达式为?计算?0.36×10-84、已知Ksp向含有Mg2+、Fe3+的溶液中滴加NaOH溶液,当两种沉淀共存且溶液的pH=8时,则C(Mg2+)=?5.61mol/LMg(OH)2Fe(OH)35.61×10-122.64×10-39一、lgc-lgc图像和Pc-Pc图像1、lgc-lgc图像为增函数,线上方的点为过饱和溶液,线下方的点为不饱和溶液2、Pc-Pc图像正好相反,线上方的点为不饱和溶液,线下方的点为过饱和溶液3、C-C图易错点:①转化能否实现②Ksp的计算(数量级)二、图像上分析离子的存在形式三、Ksp图像分析条件改变1、常温下,取一定量的PbI2固体配成饱和溶液,T时刻改变某一条件,离子浓度变化如下图7所示则PbI2的Ksp为?T时刻改变的条件为?2、已知Ag2SO4的Ksp为2.0×10-5,将适量Ag2SO4固体溶于100mL水中至刚好饱和,该饱和Ag2SO4溶液中c(Ag+)=0.034mol·L-1。若t1时刻在上述体系中加入100mL0.020mol·L-1Na2SO4溶液,下列示意图中,能正确表示t1时刻后Ag+和SO42-浓度随时间变化关系的()判断:1、向AgCl悬浊液中加入足量KI溶液,沉淀将由白色转化为黄色√2、向等浓度的KCl与K2CrO4的混合溶液中滴加少量AgNO3溶液,将生成砖红色沉淀×