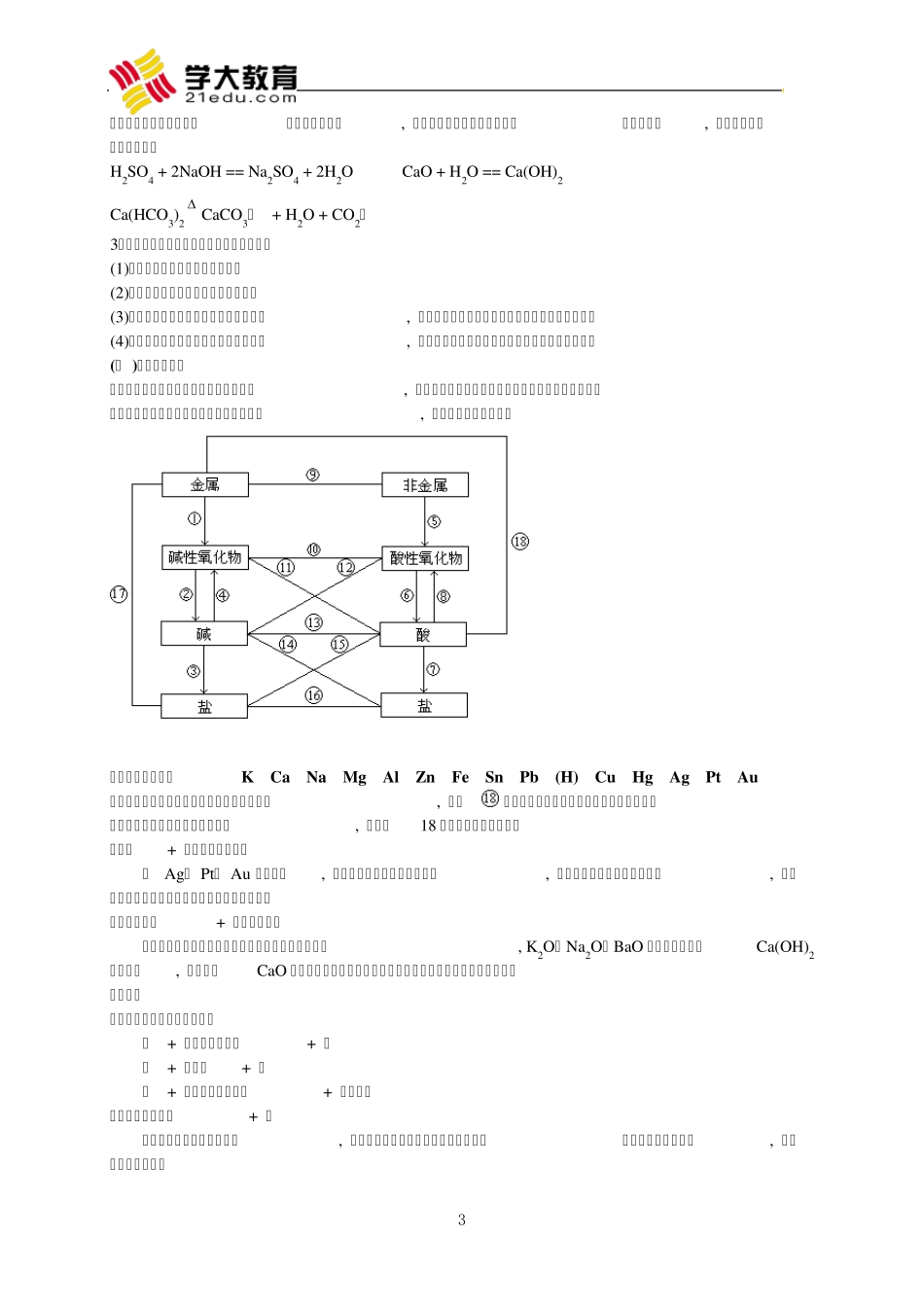
1 初中化学重要的反应类型及其反应规律 一、基础知识 (一 )化学反应类型 1、按照反应物与生成物的种类, 可把化学反应分为四种基本反应类型: 化合反应、分解反应、置换反应和复分解反应。 (1 )化合反应:由两种或两种以上的物质生成另一种物质的反应。 ①金属与非金属的化合反应。例如: 2Na + Cl2点 燃 2NaCl 3Fe + 2O2点 燃 Fe3O4 ②非金属跟非金属的化合反应。例如: 4P + 5O2点 燃 2P2O5 H2 + Cl2点 燃 2HCl ③某些碱性氧化物跟水的化合反应。例如: CaO + H2O == Ca(OH)2 Na2O + H2O == 2NaOH ④某些酸性氧化物跟水的化合反应。例如: CO2 + H2O == H2CO3 SO3 + H2O == H2SO4 ⑤酸性氧化物跟碱性氧化物的化合反应。例如: SiO2 + CaO高 温 CaSiO3 MgO + SO3 == MgSO4 ⑥多种物质之间的化合反应。例如: 2Cu + O2 + CO2 + H2O == Cu 2(OH)2CO3 CaCO3 + CO2 + H2O == Ca(HCO3)2 (2 )分解反应:由一种物质生成两种或两种以上其它物质的反应。 ①某些氧化物的分解反应。例如: 2H2O通 电 2H2↑ + O2↑ 2HgO 2Hg + O2↑ ②某些含氧酸的分解反应。例如:H2CO3 == H2O + CO2 2HClO光 照 2HCl + O2↑ (次氯酸) ③难溶性碱的分解反应。例如: Cu (OH)2 Cu O + H2O 2Fe(OH)3 Fe2O3 + 3H2O ④某些含氧酸盐的分解反应。例如: CaCO3高 温 CaO + CO2↑ 2KMn O4 K2Mn O4 + Mn O2 + O2↑ (3 )置换反应:由一种单质跟一种化合物起反应, 生成另一种单质和另一种化合物的反应。 ①金属与酸的置换反应。例如: Zn + 2HCl == Zn Cl2 + H2↑ Fe + H2SO4(稀 ) == FeSO4 + H2↑ ②金属与盐溶液的置换反应。例如: Fe + Cu SO4 == FeSO4 + Cu Cu + Hg(NO3)2 == Hg + Cu (NO3)2 ③不是在溶液中发生的置换反应。例如: H2 + Cu O Cu + H2O C + 2Cu O高 温 2Cu + CO2↑ (4 )复分解反应:由两种化合物互相交换成分, 生成另外两种化合物的反应。复分解反应主要是酸、碱、盐之间发生的化学反应, 某些金属氧化物跟酸也能发生复分解反应。 ①酸跟碱的中和反应。例如: HCl + NaOH == NaCl + H2O H2SO4 + 2KOH == K2SO4 + 2H2O 可见, 中和反应一定是复分解反应, 但复分解反应不一定是中和反应。 2 ②碱跟盐反应生成另一种碱和另一种盐。例...