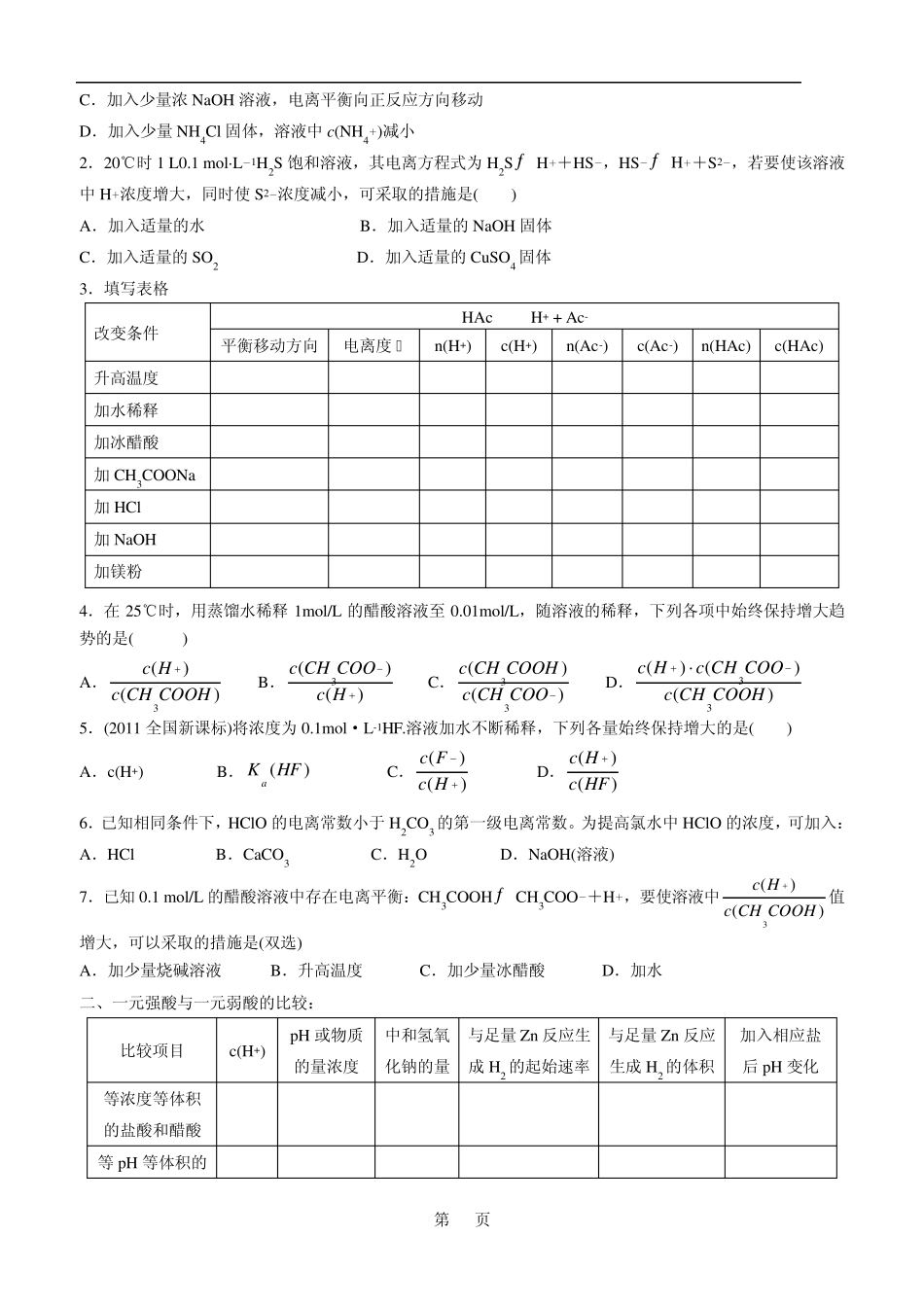
第 1 页 高三一轮复习—水溶液中的离子平衡 第一部分 弱电解质的电离 一、弱电解质的电离平衡(以CH3COOHƒ CH3COO-+ H+为例) 1.电离平衡的建立:在一定条件(如温度、浓度)下,当电解质在水溶液中 的速率和离子 的速率相等时,电离过程就达到了平衡状态。 2.特征: 3.电离度和电离常数: ⑴电离度:溶液中,弱电解质达到电离平衡时,已电离的物质的量(浓度)与初始物质的量(浓度)的比值。 ()100%n()n 已电离起始()100%c()c已电离起始 【练习】25℃时,在0.5 L 0.2mol/L 的HA 溶液中,有0.01mol 的HA 电离成离子,则该温度下HA 的电离度α 为: ③影响因素: a、温度:温度升高,电离度 ,温度越低,电离度 。 b、浓度:浓度越大,电离度 ,浓度越小,电离度 。 【练习】比较电离度大小:(填“>”或“<”号) ①20℃时,0.01 mol/L HCN 溶液 40℃时0.01 mol/L HCN 溶液。 ②10℃时0.01 mol/L CH3COOH 溶液 10℃时0.1 mol/L CH3COOH 溶液 ⑵电离常数(跟化学平衡常数一样) ①概念:一定温度下,弱电解质的电离达到平衡时,电离所产生的各种离子浓度的乘积跟未电离的分子浓度的比值是一个常数,这个常数叫做电离平衡常数,简称电离常数,用 K 表示(酸用 Ka 表示,碱用 Kb 表示) ②表达式:对于 CH3COOHƒ CH3COO-+ H+, 有Ka=)()()(33COOHCHcCOOCHcHc 【练习】①写出 NH3·H2O 的电离平衡常数 NH3·H2Oƒ NH4+ +OH- Kb= ②25℃时,在0.5L0.2mol/L 的HA 溶液中,有0.01mol 的HA 电离成离子,则该温度下HA 的电离常数为: 【注意】对于多元弱酸,电离是分步进行的,每步都有自己的电离常数,用 K1、K2 等表示: 如:H2Sƒ H+ + HS- Ka1=)SH()HS()H(2ccc ;HS-ƒ H+ + S2- Ka2= 。 通常情况下,K1 K2 K3 ③影响因素: (K 值只随 T 的变化而变化,电离是吸热过程,随 T 的升高而升高)。 ④意义:反映弱酸酸性、弱碱碱性强弱。 一定温度下,Ka 越大(多元弱酸以Ka1 为依据),弱酸电离程度越大,溶液浓度相同时,c(H+)越大,弱酸的酸性越强。 第 2 页 【练习】①298K 时,醋酸,碳酸和硼酸的电离常数分别是1.75×10-5、4.4×10-7(第一步电离)和5.8×10-10 则醋酸、碳酸和硼酸的酸性从大到小排列: ②在18℃时,H2SO3 的Kl=1.5×10-2、K2=1.0×10-7,H2S 的Kl=9.1×10-8、K2=1.1×10-12,则下列说法中正确的...