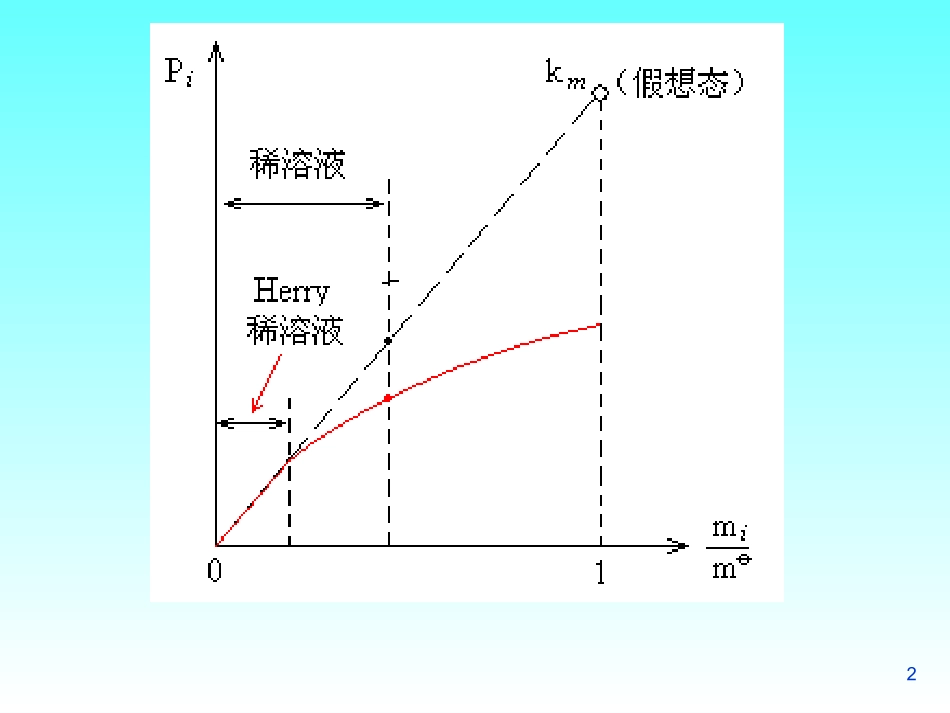
1§6.5电解质溶液的活度和活度系数1.服从Henry定律的稀溶液一、活度a、活度系数的引出i=i(T,km)+RTln(mi/m)式中:m=1mol/kg;i(T,km):标准态化学势,为浓度mi=m,且满足Henry定律:Pig=km(mi/m)=km的假想态化学势。232.一般稀溶液中,组分i对Henry定律有偏差1)式中i(T)表示假想的标准状态:mi=m,且满足Henry定律(i=1)的状态的化学势;2)活度ai及活度系数i均为无量纲量;3)上述i为非电解质组分i在水溶液中的化学势。i=i(T)+RTlnaiiiimmai=i(T)+RTlnaiiiimma4二、电解质溶液的活度、活度系数1.电解液中组分i的活度ai电解液中组分的构成较非电解质溶液要复杂。通常强电解质溶于水后,完全电离成正、负离子,不考虑生成离子对(IP)。5如:电解质M+Z+AZ溶于水。完全电离后:M+A+MZ++AZ体系自由能变化(完全电离):dG=SdT+VdP+ldnl+idni(溶剂)(溶质)其中电解质溶质引起的化学势变化:6idni=+dn++dn=+(+dni)+(dni)=(+++)dnidG=SdT+VdP+ldnl+idni代入化学势定义式,得电解质i的化学势:ln,P,Tii)nG(7+=+(T)+RTlna+其中:a+=(m+/m)+,a+为离子活度;+为离子活度系数;+(T)为假想标准态(m+=m,且+=1)的化学势。则电解质i(M+A)的“化学势”可化成:离子的化学势表达式,类似于非电解质溶质分子:8i=+++=+[+(T)+RTlna+]+[(T)+RTlna]=(+++)+RTln(a++a)或表达成:i=i(T)+RTlnai比较上两式:i(T)=++(T)+(T)——假想标准态化学势ai=a++a——离子活度之幂乘积9结论:电解质i在溶液的活度ai为其相应离子活度的幂乘积。ai=a++a对1-1型电解质:ai=a+·a102.平均活度a、平均活度系数电解质溶液中正、负离子总是同时存在;热力学方法只能得到电解质的化学势和活度;得不到单种离子的化学势和活度。所以我们采用正、负离子的平均活度a来表示电解质溶液中离子的活度。11a(a++a)1/=ai1/(其中=++)离子平均活度a为正负离子活度a+,a的几何平均。则:i=i(T)+RTlnai=i(T)+RTlna(a为可测量)定义离子平均活度:12相应地,我们定义:平均离子浓度:m(m++m)1/平均活度系数:(++)1/13则:a=a++a=[(m+/m)+]+[(m/m)]=[m++m/(m)](++)=[(m/m)]:即对于强电解质:m+=+m,m=mmmaiiimmammaiiimma14例:(1)HCl溶液,浓度m,则:m=(m++m)1/=(mm)1/2=m=(+)1/2a=(m/m)·=(m/m)a=a2=(m/m)2215(2)Na2SO4溶液,浓度m,则:+=2,=1,m+=2m,m=mm=(m++m)1/=[(2m)2(m)1]1/3=41/3m=(+2)1/3a=(m/m)=41/3(m/m)a=a3=4(m/m)33163.影响的因素(1)浓度影响:m0,1a)m↘,↗,一般情况下1;b)m增大到一定程度(3.0m)时,↗,甚至1m0.010.11.003.00(mol/L)1-1型HCl1-1型NaCl2-1型BaCl22-2型CuSO40.9040.7950.8101.320(离子水化)0.9040.7890.6590.709(离子水化)0.7250.4690.399----0.4440.1640.044----不同类型电解质的(298K)实验值17解释:m增大到一定值,离子的水化作用造成大量溶剂分子被束缚在离子水化层周围而不能自由运动;这使自由的溶剂分子数量明显下降,等效于溶质的活度剧增。活度的增加速度超过浓度的增加速度,所以也随之增大。18(2)离子价态影响a)同价型电解质稀溶液(如HCl、NaCl),浓度m相同时,相差很小;b)不同价型电解质稀溶液,浓度m相同时,正、负离子价数之积越高,越小。m0.010.11.003.00(mol...