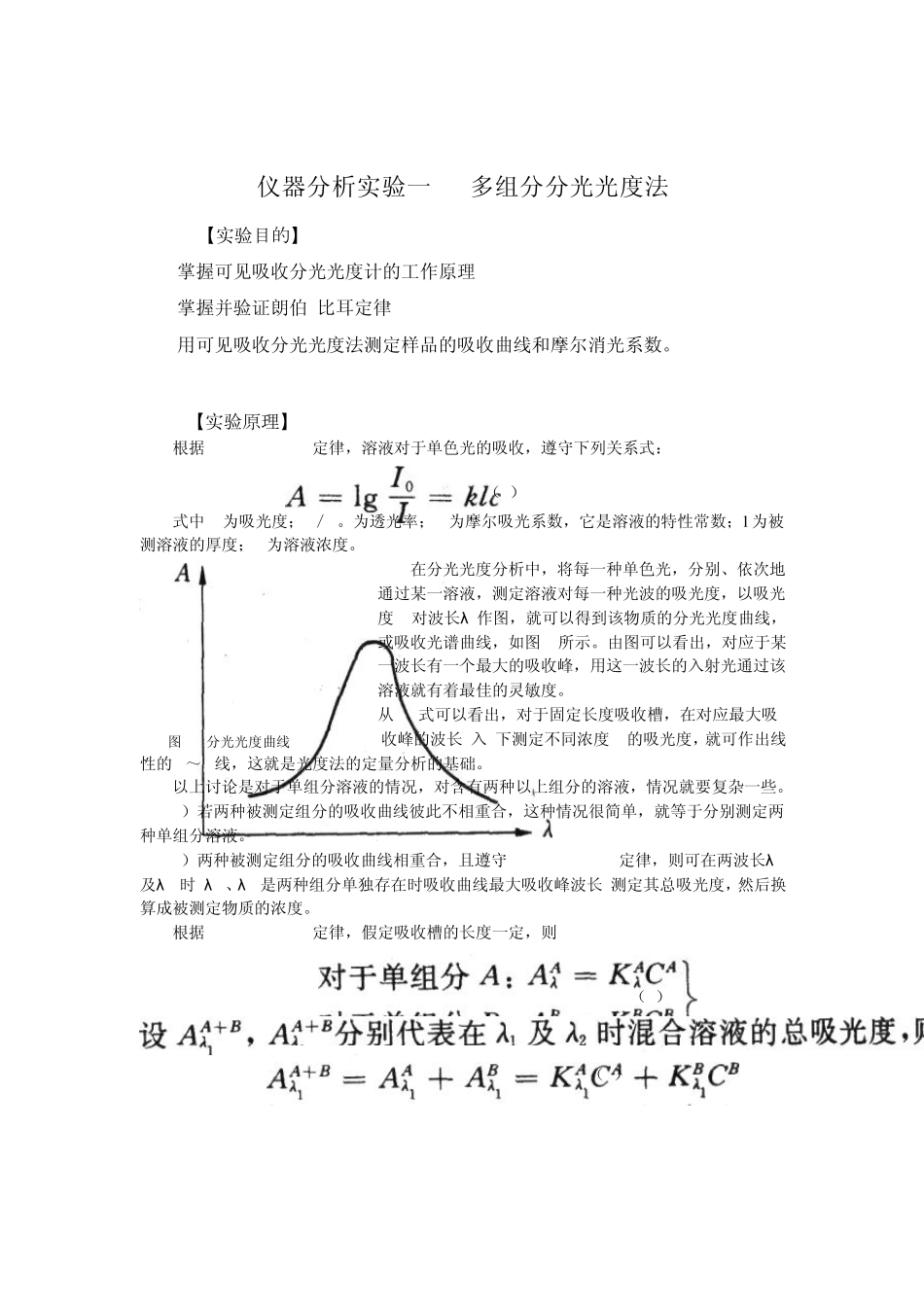
仪器分析实验一 多组分分光光度法 【实验目的】 掌握可见吸收分光光度计的工作原理 掌握并验证朗伯-比耳定律 用可见吸收分光光度法测定样品的吸收曲线和摩尔消光系数。 【实验原理】 根据Beer-Lambert定律,溶液对于单色光的吸收,遵守下列关系式: (1) 式中A为吸光度;I/I。为透光率;k为摩尔吸光系数,它是溶液的特性常数;l 为被测溶液的厚度;c为溶液浓度。 在分光光度分析中,将每一种单色光,分别、依次地通过某一溶液,测定溶液对每一种光波的吸光度,以吸光度A对波长λ 作图,就可以得到该物质的分光光度曲线,或吸收光谱曲线,如图 1所示。由图可以看出,对应于某一波长有一个最大的吸收峰,用这一波长的入射光通过该溶液就有着最佳的灵敏度。 从(1)式可以看出,对于固定长度吸收槽,在对应最大吸 图 1 分光光度曲线 收峰的波长(入)下测定不同浓度c的吸光度,就可作出线性的A~C线,这就是光度法的定量分析的基础。 以上讨论是对于单组分溶液的情况,对含有两种以上组分的溶液,情况就要复杂一些。 1)若两种被测定组分的吸收曲线彼此不相重合,这种情况很简单,就等于分别测定两种单组分溶液。 2)两种被测定组分的吸收曲线相重合,且遵守Beer-Lambert定律,则可在两波长λ1及λ2时(λ1、λ2是两种组分单独存在时吸收曲线最大吸收峰波长)测定其总吸光度,然后换算成被测定物质的浓度。 根据Beer-Lambert定律,假定吸收槽的长度一定,则 (2) (3) (4) 此处AAλ 1、AAλ 2、ABλ 1、ABλ 2分别代表在λ1及λ2时组分 A和 B的吸光度。由(3)式可得: (5) 将(5)式代入(4)式得: (6) 这些不同的 K值均可由纯物质求得,也就是说,在纯物质的最大吸收峰的波长λ 时,测定吸光度 A和浓度 c的关系。如果在该波长处符合贝尔一郎比定律,那么 A~C为直线,直线的斜率为 K值,是混合溶液在λ1、λ2时测得的总吸光度,因此根据(5)、(6)式即可计算混合溶液中组分 A和组分 B的浓度。 3)若两种被测组分的吸收曲线相互重合,而又不遵守贝尔-郎比定律。 4)混合溶液中含有未知组分的吸收曲线。 3与 4两种情况,由于计算及处理比较复杂,此处不讨论。 本实验是用分光光度法测定弱电解质(甲基红)的电离常数,由于甲基红本身带有颜色,而且在有机溶剂中电离度很小,所以用一般的化学分析法或其它物理化学方法进行测定都有困难,但用分光光度法可不必将其分离,且同时能测定两组分的浓度。甲基红...