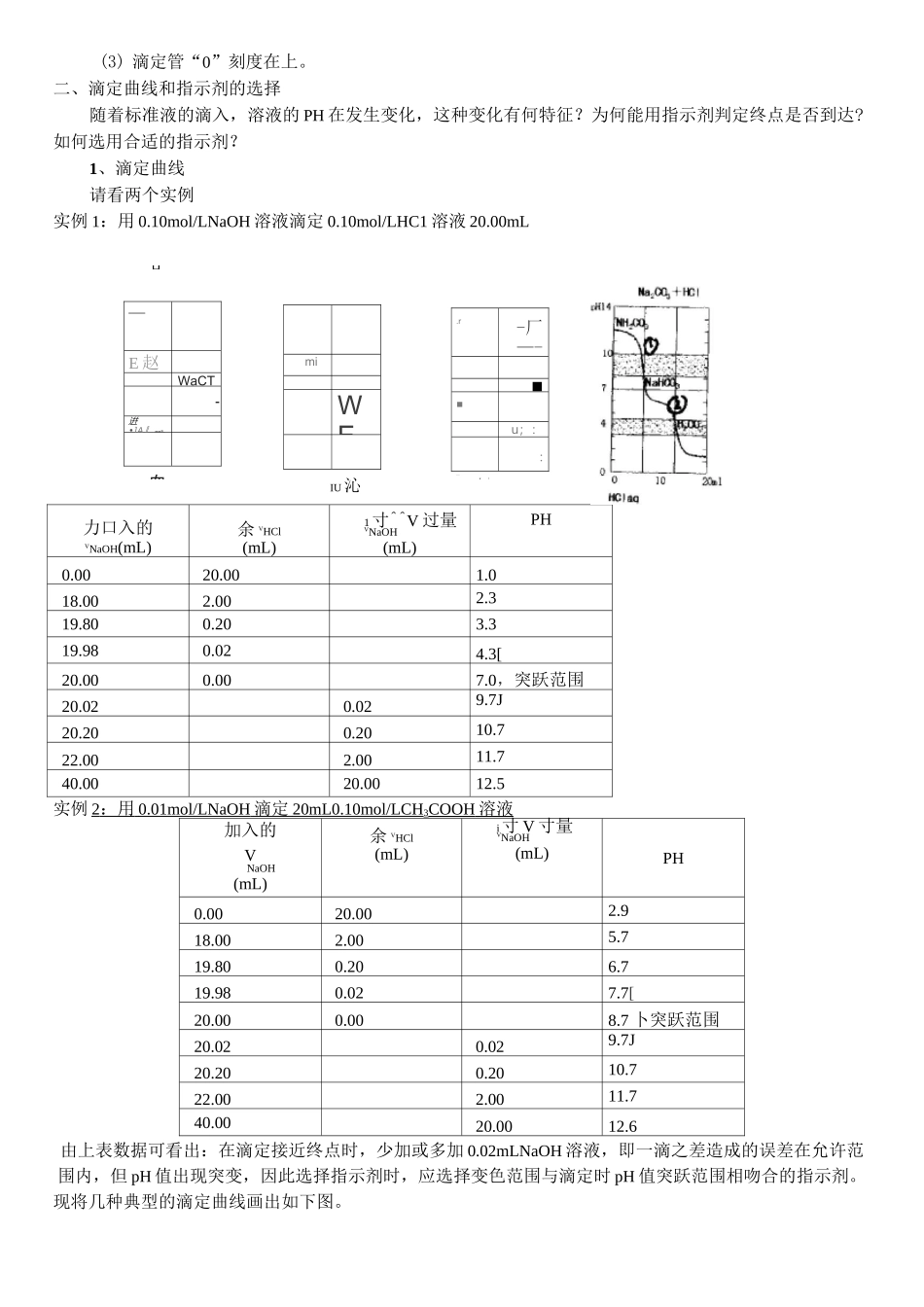
高中化学 58 个考点精讲34、酸碱中和滴定1.复习重点1、理解中和滴定的基本原理2、掌握滴定的正确步骤,了解所用仪器的结构(两种滴定管)。3、理解指示剂的选用原则和终点颜色变化判定。4、学会误差分析及成因2.难点聚焦一、中和反应及中和滴定原理1、中和反应:酸+碱►正盐+水如:① Hcl+NaOH===NaCl+H2O② H2SO4+2NaOH====Na2SO4+2H2O③ N3PO4+3NaOH====Na3PO4+3H2O注意:①酸和碱恰好完全中和,溶液不一定呈中性,由生成的盐性质而定。②由于所用指示剂变色范围的限制,滴定至终点不一定是恰好完全反应时,但应尽量减少误差。2、中和滴定原理由于酸、碱发生中和反应时,反应物间按一定的物质的量之比进行,基于此,可用滴定的方法确定未知酸或碱的浓度。对于反应:HA+BOH====BA+H2O1mol1molC.VC.V(HA)(HA)(BOH)(BOH)即可得 C(HA).V(HA)===C(BOH).V(BOH)C.VC=( BOH )( BOH ) (HA)V(HA)若取一定量的 HA 溶液(V 足),用标准液 BOH[已知准确浓度来滴定,至终点时消耗标准液的体足(标)积可读出(V 读)代入上式即可计算得 C(HA)读(HA)C.VC=—标读(HA)V定若酸滴定碱,与此同理若酸为多元酸,HnA+nBOH===BnA+nH2O1molnmolC.V(HA)(HA)C.V(BOH)(BOH)C则右关系 C—(BOH).V(HA)则有大系:C(HB)3、滴定方法的关键(1)准确测定两种反应物的溶液体积(2)确保标准液、待测液浓度的准确(3)滴定终点的准确判定(包括指示剂的合理选用)4、滴定实验所用的仪器和操作要点(1)仪器:酸式滴定管、碱式滴定管、滴定管夹(带铁架台)、锥形瓶(或烧杯+玻棒)、量筒(或移液管)(2)操作:①滴定前的准备:查漏、洗涤、润洗、充液(赶气泡)调液面、读数。② 滴定:移液、滴加指示剂、滴定至终点、读数。③计算。—E 赵玄・WaCT-逬•]A』,■■ii-miWE.r-厂—-■■u;:_:(3) 滴定管“0”刻度在上。二、滴定曲线和指示剂的选择随着标准液的滴入,溶液的 PH 在发生变化,这种变化有何特征?为何能用指示剂判定终点是否到达?如何选用合适的指示剂?1、滴定曲线请看两个实例实例 1:用 0.10mol/LNaOH 溶液滴定 0.10mol/LHC1 溶液 20.00mL力口入的VNaOH(mL)余 VHCl(mL)1寸^^V 过量VNaOH(mL)PH0.0020.001.018.002.002.319.800.203.319.980.024.3[20.000.007.0,突跃范围20.020.029.7J20.200.2010.722.002.0011.740.0020.0012.5实例 2 :用 0.01mol/LNaOH 滴定 20mL0.10mol/LCH 3COOH 溶液...