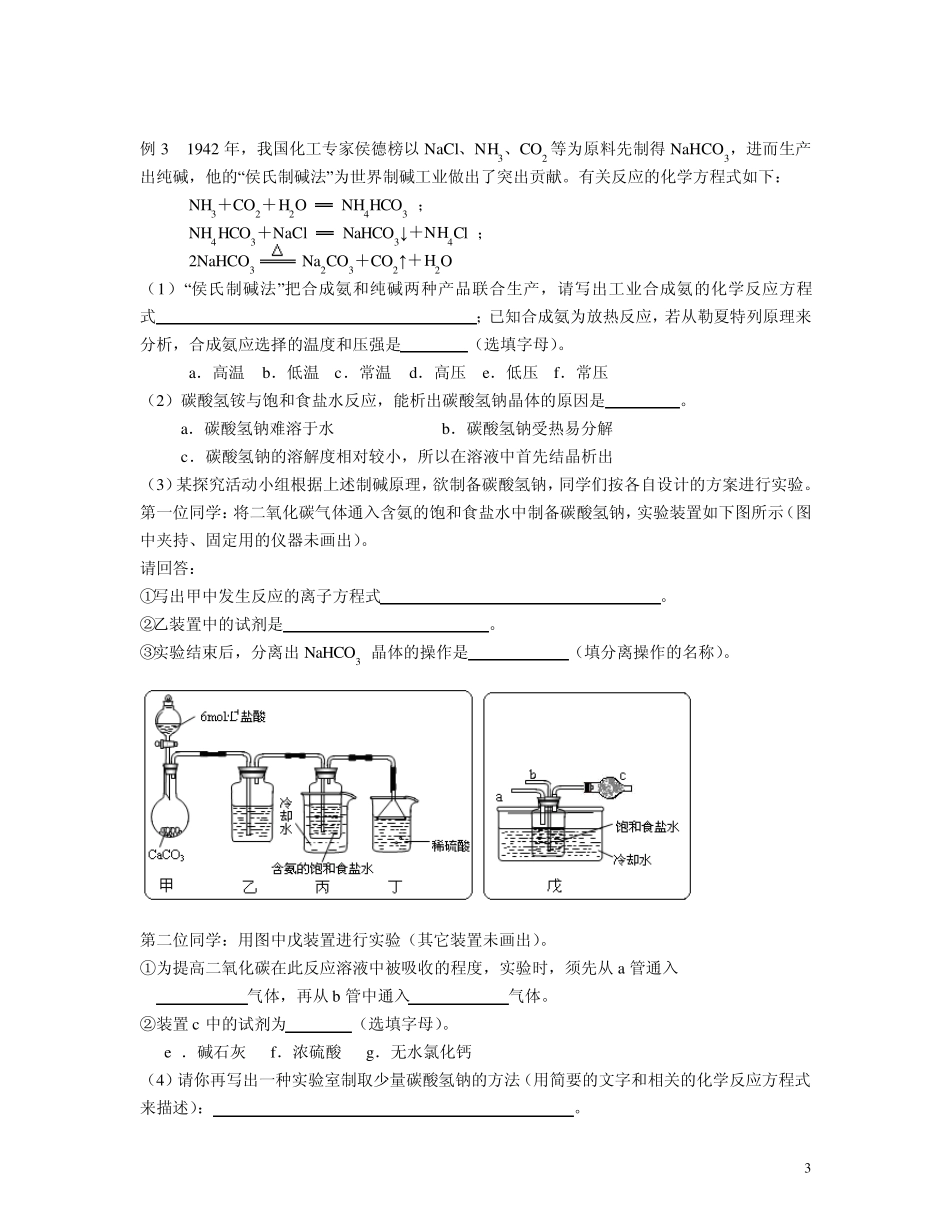
1 侯氏制碱法的原理及应用 小结:工业制纯碱的方法: 1 .氨碱法(索尔维制碱法) 向饱和食盐水中通入足量氨气至饱和,然后在加压下通入CO2(由CaCO3 煅烧而得),因NaHCO3溶解度较小,故有下列反应发生: NH3+CO2+H2O=NH4HCO3 NaCl+NH4HCO3=NaHCO3↓ +NH4Cl 将析出的NaHCO3 晶体煅烧,即得Na2CO3: 2NaHCO3 Na2CO3+CO2↑+H2O 母液中的NH4Cl 加消石灰可回收氨,以便循环使用: 2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O 此法优点:原料经济,能连续生产,CO2 和NH3 能回收使用. 缺点:大量CaCl2 用途不大,NaCl 利用率只有70%,约有30%的NaCl 留在母液中。 2 .联合制碱法(侯氏制碱法) 根据NH4Cl 在常温时的溶解度比NaCl 大,而在低温下却比NaCl 溶解度小的原理,在278K~283K(5℃~10℃)时,向母液中加入食盐细粉,而使NH4Cl 单独结晶析出供做氮肥. 此法优点:保留了氨碱法的优点,消除了它的缺点,使食盐的利用率提高到 96%;NH4Cl 可做氮肥;可与合成氨厂联合,使合成氨的原料气CO 转化成 CO2,革除了 CaCO3 制CO2 这一工序。 例 1 1892 年,比利时人索尔维以NaCl、CO2、H2O、NH3 为原料生产Na2CO3,叫索尔维法.其主要步骤是:(1)在NH3 饱和的NaCl 溶液中通入CO2 制得NaHCO3;(2)再将NaHCO3 焙烧制得纯碱,CO2 循环使用;(3)在析出小苏打的母液中加入生石灰,NH3 循环使用.1940 年,我国著名化工专家侯德榜先生,冲破了“索尔维”法的技术封锁,并加以改进,用NaCl 固体代替生石灰,加入母液使NH4Cl 晶体析出,生产出纯碱和氯化铵.这便是举世闻名的“侯氏制碱法”.试回答: (1)在氨饱和NaCl 溶液中通入CO2 的两步反应方程式为 。 (2)不能在NaCl 溶液中通入CO2 制NaHCO3 的原因 。 (3)析出小苏打的母液中加入生石灰的反应方程式是 。 (4)“侯氏制碱法”与“索尔维法”相比其优点是 。 例 1 解析:CO2 在水中发生反应:CO2+H2OH2CO3H++HCO 3 ,因为碳酸是弱酸,所以HCO 3 在水溶液中浓度很小;但是在通入氨气后,氨气在水溶液中也发生反应:NH3+H2ONH3·H2ONH 4 +OH-,所得到的少量OH-和前一反应中的H+结合生成极弱的电解质 H2O,从而使得两个反应都向右进行,可以使溶液中HCO 3 的浓度变大,由于 NaHCO3溶解度较小,所以可析出NaHCO3 晶体,母液中为 NH4Cl,加入生石灰可生成 NH3 和CaCl2,改用NaCl,利用NH4Cl...