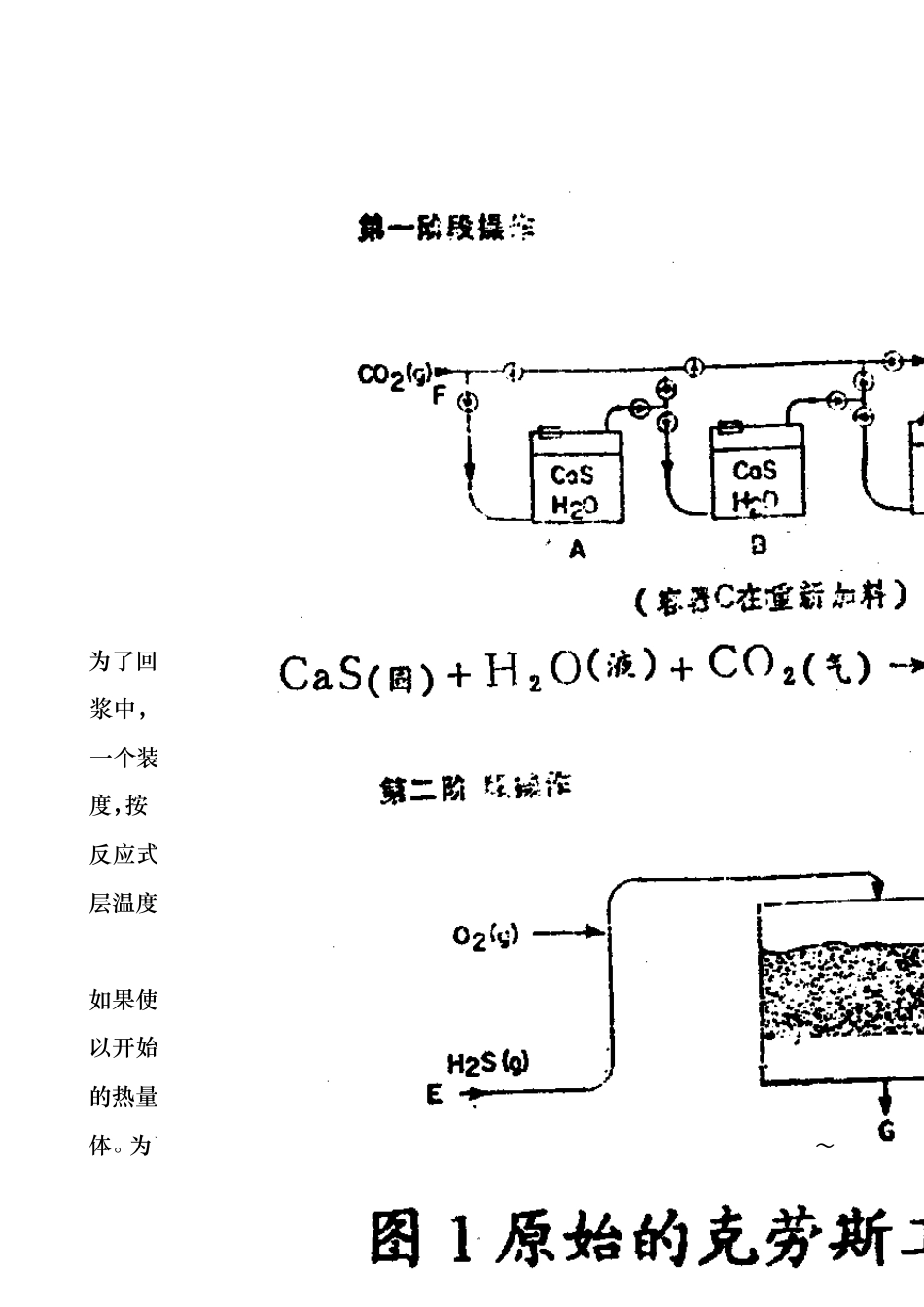
1 前 言 在石油和天然气加工过程中产生大量的 H2S气体,为了保护环境和回收元素硫,工业上普遍采用克劳斯过程处理含有 H2S的酸性气体,其反应方程式如下: ’ H2S + 3/2 O2 = S02 + H2O (1) 2H2S + S02 = 3/X Sx +2H2O (2) 其中反应(1)和(2)是在高温反应炉中进行的,在催化反应区(低于538℃)除了发生反应(2)外,还进行下述有机硫化物的水解反应: CS2 + H2O = COS + H2S (3) COS + H20 = H2S + C02 (4) 本文回顾了改良克劳斯硫磺回收工艺的发展历程,阐明了工艺方法的基本原理、影响因素及操作条件,进行了扼要的评述. 1、工艺的发展历程 1.1原始的克劳斯工艺 1883年英国化学家 C,F〃C1aus首先提出回收元素硫的专利技术,至今已有 100多年历史。原始的克劳斯法是一个两步过程,其工艺流程示于图 1,专门用于回收吕布兰(Leblanc)法生产碳酸钠时所消耗的硫。关于后者的反应过程列于下式: 2NaCl + H2S04 = Na2SO4 + 2HCl (5) Na2SO4 + 2C = Na2S + 2CO2 (6) Na2S + CaCO3 = Na2CO3 + CaS (7) 2 为了回收元素硫,第一步是把 CO2导入由 H20和 CaS(碱性废料)组成的液浆中,按上述反应式得到 H2S,然后在第二步将 H2S和 O2混合后,导入一个装有催化剂的容器,催化剂床层则预先以某种方式预热至所需要的温度,按 ←CaS(固)+ H2O (液)+C02(气)= CaC03(固)十 H2S(气) (8) 反应式(9)进行反应。反应开始后,用控制反应物流的方法来保持固定的床层温度.显然此工艺只能在催化剂上以很低的空速进行反应。据报导, H2S + 1/2 O2 = 1/X Sx + H2O (9) 如果使用了水合物形式的铁或锰的氧化物,就不需要预热催化剂床层即可以开始反应,然而由于 H2S和 O2之间的反应是强烈的放热反应,而释放的热量又只靠辐射来发散,因此限制了克劳斯窑炉只能处理少量的 H2S气体。为了使产率达到 80 ~ 90%,每小时在每体积催化剂上只能处理 2~ 3 3体积的 H2S气体;为了加快热量散发从而增加处理容量,亦曾试图在窑炉中设臵冷却盘管,使冷的废气循环通过窑炉,结果并不成功,此后尽管又进行了种种尝试,但在二十世纪三十年代以前,该法并没有在工业领域得到推广,其原因是如上所述的那样,将 H2S和 O2在反应器内直接进行氧化反应,生成的大量反应热无法移出,致使反应器内温度猛升,为了控制反应温度,只得采用相当低的空速,故因生产能力低下而阻碍了该法的工...